अध्याय 1: हमारे आसपास के पदार्थ/पदार्थ की प्रकृति
हमारी दुनिया विविध प्रकार के पदार्थों से बनी है – हवा, पानी, लकड़ी, लोहा, कपड़े, भोजन, और न जाने कितने प्रकार की चीजें। लेकिन क्या कभी आपने सोचा है कि इन सभी की रचना किससे हुई है? और इन्हें हम किस आधार पर एक-दूसरे से अलग कर सकते हैं?
इस अध्याय में हम जानेंगे:
- पदार्थ क्या होते हैं और उनकी विशेषताएँ क्या हैं
- पदार्थों को ठोस, द्रव और गैस जैसे रूपों में कैसे वर्गीकृत किया जाता है
- पदार्थों के गुण जैसे आकार, आयतन और संपीडनशीलता
- पदार्थों की अवस्थाओं में परिवर्तन – पिघलना, वाष्पन, संघनन आदि
- ताप और दाब के प्रभाव से पदार्थों की अवस्था में परिवर्तन
यह अध्याय न केवल हमारे आसपास की दुनिया को समझने में मदद करता है, बल्कि यह भी सिखाता है कि वैज्ञानिक किस तरह चीजों को मापते, वर्गीकृत करते और उनके व्यवहार को समझते हैं।
आइए, इस अद्भुत यात्रा की शुरुआत करते हैं और जानें कि वास्तव में हमारे आसपास क्या है!
पदार्थ का भौतिक स्वरूप
विज्ञान के अनुसार, पदार्थ वह होता है जिससे कोई वस्तु बनी होती है और जिसमें द्रव्यमान (mass) और आयतन (volume) होता है। इस खंड में हम जानेंगे कि पदार्थ का मूलभूत या भौतिक स्वरूप कैसा होता है।
प्रमुख बिंदु:
- सभी पदार्थ सूक्ष्म कणों से मिलकर बने होते हैं।
- इन कणों के बीच रिक्त स्थान (space) होता है।
- कण लगातार गतिशील रहते हैं।
- कणों के बीच आकर्षण बल भी होता है।
1. पदार्थ कणों से मिलकर बने होते हैं
हर पदार्थ अनेक छोटे-छोटे कणों से बना होता है जिन्हें हम सामान्य आंखों से नहीं देख सकते। उदाहरण के लिए, जब चीनी को पानी में घोला जाता है, तो वह आंखों से अदृश्य हो जाती है — इसका मतलब है कि उसके कण पानी में फैल गए हैं।
2. कणों के बीच रिक्त स्थान होता है
जब हम कोई घुलनशील पदार्थ जैसे नमक या चीनी को पानी में डालते हैं, तो वे उसके अंदर मिल जाते हैं। इसका अर्थ यह है कि पानी के कणों के बीच खाली स्थान होता है, जिसमें अन्य कण समा सकते हैं।
3. कण गतिशील होते हैं
पदार्थ के कण लगातार गति में रहते हैं। अगर आप अगरबत्ती जलाते हैं, तो उसकी खुशबू कमरे में फैल जाती है – यह इस बात का प्रमाण है कि वाष्पित कण गति कर रहे हैं।
4. कणों के बीच आकर्षण बल होता है
कण एक-दूसरे को आकर्षित करते हैं। यह आकर्षण बल ही यह तय करता है कि पदार्थ ठोस, द्रव या गैस रूप में होगा।
निष्कर्ष:पदार्थ के भौतिक स्वरूप को समझना विज्ञान की नींव है। कणों का अस्तित्व, उनकी गति, आकर्षण और उनके बीच रिक्त स्थान – ये सभी हमें यह समझने में मदद करते हैं कि पदार्थ व्यवहार कैसे करते हैं।
अभ्यास प्रश्न एवं उत्तर
1. निम्नलिखित में से कौन-से पदार्थ हैं?
प्रश्न: कुर्सी, वायु, स्नेह, गंध, घृणा, बादाम, विचार, शीत, नींबू पानी, इत्र की सुगंध।
उत्तर: पदार्थ वे हैं जिनका द्रव्यमान होता है और जो स्थान घेरते हैं।
पदार्थ नहीं हैं: स्नेह, गंध, घृणा, विचार, शीत
2. गर्मा-गरम खाने की गंध कई मीटर दूर से ही क्यों महसूस होती है?
प्रश्न: लेकिन ठंडे खाने की महक लेने के लिए पास जाना पड़ता है, क्यों?
उत्तर: यह पदार्थों के कणों की गतिशीलता और तापमान के प्रभाव के कारण होता है।
3. गोताखोर पानी काट पाता है, इससे कौन-सा गुण ज्ञात होता है?
उत्तर: इससे यह सिद्ध होता है कि:
4. पदार्थ के कणों की क्या विशेषताएँ होती हैं?
उत्तर: पदार्थ के कणों की प्रमुख विशेषताएँ निम्नलिखित हैं:
- सभी पदार्थ बहुत सूक्ष्म कणों से मिलकर बने होते हैं।
- कणों के बीच रिक्त स्थान होता है।
- कण निरंतर गतिशील रहते हैं।
- कणों के बीच आपसी आकर्षण बल होता है।
पदार्थ की अवस्थाएँ
हमारे चारों ओर पाए जाने वाले पदार्थ मुख्य रूप से तीन अवस्थाओं में पाए जाते हैं:
- ठोस अवस्था (Solid)
- द्रव अवस्था (Liquid)
- गैस अवस्था (Gas)
पदार्थ की यह अवस्थाएँ उसके कणों की व्यवस्था, गति, आकर्षण बल और रिक्त स्थान पर निर्भर करती हैं।
1. ठोस अवस्था (Solid State)
जब पदार्थ के कण बहुत पास-पास होते हैं और उनमें आपसी आकर्षण बल बहुत अधिक होता है, तो वह ठोस अवस्था में होता है।
ठोस अवस्था की विशेषताएँ:
- ठोस का निश्चित आकार और आयतन होता है।
- इसके कण एक-दूसरे के बहुत पास होते हैं।
- कणों के बीच आकर्षण बल बहुत अधिक होता है।
- कण बहुत कम गति करते हैं – केवल कम्पन करते हैं।
- इन्हें दबाना या संपीडित करना मुश्किल होता है।
वैज्ञानिक कारण:
ठोस पदार्थों में कण एक-दूसरे से इतने मजबूती से जुड़े होते हैं कि वे अपनी स्थिति नहीं बदल सकते। यही कारण है कि ठोस पदार्थ को एक निश्चित आकार और रूप में देखा जा सकता है।
2. द्रव अवस्था (Liquid State)
जब पदार्थ के कण एक-दूसरे के उतने पास नहीं होते जितने ठोस में, और उनमें गति की थोड़ी अधिक स्वतंत्रता होती है, तो वह द्रव अवस्था में होता है। द्रवों में बहने की क्षमता होती है, इसलिए इन्हें “तरल” भी कहा जाता है।
द्रव अवस्था की विशेषताएँ:
- द्रव का निश्चित आयतन होता है, पर निश्चित आकार नहीं होता।
- द्रव पात्र का आकार ग्रहण कर लेते हैं।
- कणों के बीच आकर्षण बल मध्यम होता है।
- कण एक-दूसरे के पास होते हैं लेकिन सरक सकते हैं।
- द्रवों को थोड़ा बहुत संपीडित किया जा सकता है।
वैज्ञानिक व्याख्या:
द्रवों के कण एक-दूसरे के ऊपर फिसल सकते हैं, इसलिए वे आसानी से बह सकते हैं। यह अवस्था ठोस की तुलना में अधिक गतिशील होती है और गैस से कम।
ताप और दाब का प्रभाव:
तापमान बढ़ने पर द्रव गैस में बदल सकता है (वाष्पीकरण) और ठंडा करने पर ठोस में (जमाव)।
3. गैस अवस्था (Gaseous State)
जब पदार्थ के कण एक-दूसरे से बहुत दूर होते हैं और अत्यधिक गतिशील होते हैं, तब वह गैस अवस्था में होता है। गैसों में न तो निश्चित आकार होता है और न ही निश्चित आयतन।
गैस अवस्था की विशेषताएँ:
- गैस का न तो निश्चित आकार होता है और न ही आयतन।
- गैस पूरा पात्र भर लेती है जिसमें वह रखी जाती है।
- कणों के बीच आकर्षण बल बहुत कम होता है।
- कण एक-दूसरे से काफी दूर होते हैं और तेजी से गति करते हैं।
- गैसें संपीडनीय होती हैं (compressible)।
- गैसें आसानी से फैलती हैं (diffusion)।
वैज्ञानिक कारण:
गैसों के कणों में बहुत अधिक गति और कम आकर्षण बल होने के कारण वे चारों ओर स्वतंत्र रूप से फैल सकते हैं।
ताप और दाब का प्रभाव:
गैस को ठंडा करके द्रव में बदला जा सकता है (संघनन), और दबाव बढ़ाकर गैस को संपीडित किया जा सकता है।
ठोस, द्रव और गैस अवस्था की तुलना
| विशेषता | ठोस (Solid) | द्रव (Liquid) | गैस (Gas) |
|---|---|---|---|
| आकार | निश्चित | नहीं | नहीं |
| आयतन | निश्चित | निश्चित | नहीं |
| प्रवाह क्षमता | नहीं | हां | हां |
| संपीडनीयता | बहुत कम | कम | बहुत अधिक |
| कणों की दूरी | बहुत कम | मध्यम | अधिक |
| कणों की गति | बहुत कम (कम्पन) | थोड़ी अधिक | बहुत अधिक |
| आकर्षण बल | बहुत अधिक | मध्यम | बहुत कम |
यह तालिका कक्षा 9 के छात्रों को तीनों अवस्थाओं की स्पष्ट समझ देने में मदद करती है।
अभ्यास प्रश्न एवं उत्तर – भाग 2
1. घनत्व के बढ़ते क्रम में व्यवस्थित करें:
घनत्व = द्रव्यमान / आयतन
उत्तर: वायु < चिमनी का धुआँ < रुई < जल < शहद < चॉक < लोहा
2. (a) पदार्थ की अवस्थाओं की तुलना:
| गुण | ठोस | द्रव | गैस |
|---|---|---|---|
| आकार | निश्चित | नहीं | नहीं |
| आयतन | निश्चित | निश्चित | नहीं |
| तरलता | नहीं | हां | हां |
| संपीड्यता | बहुत कम | थोड़ी | अधिक |
| घनत्व | अधिकतम | मध्यम | न्यूनतम |
3. (b) टिप्पणियाँ:
- दृढ़ता: ठोस पदार्थों में अधिक, गैसों में सबसे कम।
- संपीड्यता: गैसें अत्यधिक संपीडनीय, ठोस नहीं।
- तरलता: द्रव और गैस बह सकते हैं, ठोस नहीं।
- बर्तन में गैस का भरना: गैसें बर्तन का पूरा आकार लेती हैं।
- आकार: ठोस का निश्चित, द्रव और गैस का नहीं।
- गतिज ऊर्जा: गैस में सबसे अधिक, फिर द्रव, ठोस में न्यूनतम।
- घनत्व: ठोस में सबसे अधिक, गैस में सबसे कम।
4. कारण बताइए:
(a) गैस बर्तन को पूरा भर देती है:
क्योंकि गैस के कण स्वतंत्र रूप से चारों दिशाओं में गति करते हैं और वे बर्तन के पूरे क्षेत्र में फैल जाते हैं।
(b) गैस बर्तन की दीवारों पर दबाव डालती है:
गैस के गतिशील कण दीवारों से टकराते हैं, जिससे वे दबाव उत्पन्न करते हैं।
(c) लकड़ी की मेज़ ठोस कहलाती है:
क्योंकि इसका निश्चित आकार और आयतन है, और इसके कण निकटता से जुड़ें होते हैं।
(d) हवा में हाथ आसानी से चल जाता है लेकिन लकड़ी में नहीं:
क्योंकि हवा के कणों में रिक्त स्थान अधिक होता है और आपसी आकर्षण कम, जबकि ठोस में कण बहुत पास और दृढ़ होते हैं।
5. बर्फ जल में क्यों तैरती है?
क्या पदार्थ अपनी अवस्था को बदल सकते हैं?
हां, कर सकते हैं। पदार्थ तापमान और दाब में परिवर्तन के कारण एक अवस्था से दूसरी अवस्था में परिवर्तित हो सकते हैं। इसे “अवस्था परिवर्तन” कहा जाता है।
अवस्था परिवर्तन के कारण:
- तापमान में परिवर्तन (Change in Temperature)
- दाब में परिवर्तन (Change in Pressure)
अवस्था परिवर्तन के प्रकार:
| अवस्था परिवर्तन | प्रक्रिया का नाम | उदाहरण |
|---|---|---|
| ठोस → द्रव | पिघलना (Melting) | बर्फ का पानी बनना |
| द्रव → गैस | वाष्पीकरण / उत्क्रमण | पानी का भाप बनना |
| गैस → द्रव | संघनन (Condensation) | भाप से पानी बनना |
| द्रव → ठोस | जमना (Freezing) | पानी का बर्फ बनना |
| ठोस → गैस | उर्ध्वपातन (Sublimation) | कपूर का गायब होना |
| गैस → ठोस | पुन: संघनन | ठंडी सतह पर बर्फ की परत |
उदाहरण से समझिए:
- जब बर्फ को गर्म किया जाता है, तो वह पिघलकर पानी बन जाती है।
- यदि हम पानी को और अधिक गर्म करें, तो वह भाप में बदल जाता है।
- भाप को ठंडा करने पर वह फिर से पानी में बदल जाता है।
तापमान परिवर्तन का प्रभाव
जब किसी पदार्थ का तापमान बदला जाता है, तो उसके कणों की गतिज ऊर्जा (kinetic energy) भी बदल जाती है। यह परिवर्तन पदार्थ की अवस्था को प्रभावित कर सकता है। आइए जानें तापमान परिवर्तन के प्रभावों को विस्तार से:
तापमान बढ़ने पर पदार्थ के कण अधिक तेजी से हिलने लगते हैं जिससे वे एक-दूसरे से अलग होकर एक नयी अवस्था में बदल सकते हैं।
1. ठोस से द्रव में परिवर्तन (गलन / Melting)
जब किसी ठोस को गर्म किया जाता है, तो उसकी कणों की गतिज ऊर्जा बढ़ जाती है। एक निश्चित तापमान (गलनांक) पर, ठोस द्रव में बदल जाता है।
2. द्रव से गैस में परिवर्तन (वाष्पीकरण / Vaporisation)
द्रव को और गर्म करने पर उसकी गतिज ऊर्जा और अधिक बढ़ जाती है। एक निश्चित तापमान (उबालांक) पर, वह गैस में बदल जाता है।
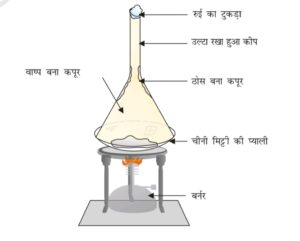
3. ठोस से गैस में परिवर्तन (उर्ध्वपातन / Sublimation)
कुछ ठोस पदार्थ ताप देने पर सीधे गैस में बदल जाते हैं। इसे उर्ध्वपातन कहते हैं।
4. गैस से द्रव में परिवर्तन (संघनन / Condensation)
जब गैस को ठंडा किया जाता है, तो उसके कणों की गतिज ऊर्जा घट जाती है और वे एक-दूसरे के निकट आकर द्रव अवस्था में बदल जाते हैं।
5. द्रव से ठोस में परिवर्तन (वजियन / Solidification)
जब द्रव को ठंडा किया जाता है, तो वह ठोस में बदल जाता है।
| परिवर्तन | प्रभाव | उदाहरण |
|---|---|---|
| गलन | ठोस से द्रव | बर्फ से जल |
| वाष्पीकरण | द्रव से गैस | जल से भाप |
| उर्ध्वपातन | ठोस से गैस | कपूर |
| संघनन | गैस से द्रव | भाप से जल |
| वजियन | द्रव से ठोस | जल से बर्फ |
निष्कर्ष:
तापमान पदार्थ की अवस्थाओं में परिवर्तन का मुख्य कारण है। यह कणों की गति और आपसी आकर्षण बल को प्रभावित करता है, जिससे एक अवस्था दूसरी में परिवर्तित हो जाती है।
दाब परिवर्तन का प्रभाव
जब किसी गैस पर दाब डाला जाता है और उसका तापमान नीचे लाया जाता है, तो वह द्रव में परिवर्तित हो सकती है।
पदार्थ की अवस्था को बदलने में दाब का महत्वपूर्ण प्रभाव होता है। विशेषकर गैसों को द्रव में परिवर्तित करने के लिए दाब को बढ़ाया जाता है और साथ ही तापमान को कम किया जाता है। यह प्रक्रिया दाब-संपीड़न कहलाती है।
कैसे करता है दाब कार्य?
- जब गैस पर अधिक दाब डाला जाता है, तो उसके कण पास-पास आ जाते हैं।
- यदि साथ में तापमान भी कम किया जाए, तो गैस के कणों की ऊर्जा और गति घट जाती है।
- यह दोनों प्रभाव गैस को द्रव में बदल देते हैं।
उदाहरण:
निष्कर्ष:
दाब को बढ़ाकर और तापमान को घटाकर गैस को द्रव में बदला जा सकता है। यह सिद्धांत गैसों के संपीड़न, द्रवीकरण तथा औद्योगिक गैस भंडारण में उपयोगी होता है।
वाष्पीकरण को प्रभावित करने वाले कारक
वाष्पीकरण एक भौतिक प्रक्रिया है जिसमें द्रव सतह से कण उड़कर गैस में परिवर्तित हो जाते हैं। वाष्पीकरण की दर कई कारकों पर निर्भर करती है। आइए जानें वे कौन-कौन से कारक हैं:
- सतह क्षेत्र (Surface Area):
द्रव की सतह जितनी अधिक होगी, उतने अधिक कण सतह से उड़ सकते हैं। इसलिए वाष्पीकरण तेज होता है।उदाहरण: पानी थाली में जल्दी सूखता है जबकि गिलास में देर से। - तापमान (Temperature):
उच्च तापमान पर कणों की ऊर्जा बढ़ जाती है जिससे अधिक कण उड़ सकते हैं और वाष्पीकरण तेज होता है। - हवा की गति (Wind Speed):
तेज हवा उड़ चुके कणों को हटा देती है, जिससे सतह से और कण उड़ने के लिए जगह बनती है। - वायुमंडलीय आर्द्रता (Humidity):
वातावरण में पहले से ही जलवाष्प की मात्रा अधिक होने पर वाष्पीकरण धीमा हो जाता है।उदाहरण: नमी वाले दिन कपड़े देर से सूखते हैं। - द्रव का प्रकार (Nature of Liquid):
अलग-अलग द्रवों की वाष्पीकरण दर अलग होती है। जैसे, पेट्रोल पानी की तुलना में अधिक तेजी से वाष्पित होता है।
वाष्पीकरण एक शीतलन प्रक्रिया (cooling process) भी है क्योंकि इसमें द्रव के तेज गति वाले कण उड़ जाते हैं और बचे हुए द्रव का तापमान घट जाता है।
वाष्पीकरण के कारण शीतलता कैसे होती है?
वाष्पीकरण केवल द्रव को गैस में बदलने की प्रक्रिया नहीं है, बल्कि यह एक शीतलन प्रक्रिया (Cooling Process) भी है। जब कोई द्रव वाष्पित होता है, तो वह अपने आसपास की गर्मी को सोखता है, जिससे वातावरण में ठंडक महसूस होती है।
जब द्रव के कण वाष्पित होते हैं, तो सबसे तेज गति वाले कण पहले उड़ते हैं। ये कण वाष्प बनने के लिए ऊर्जा (गर्मी) को सतह से लेते हैं। जिससे शेष द्रव और उसका आस-पास का भाग ठंडा हो जाता है।
दैनिक जीवन में उदाहरण
- पसीने का वाष्पीकरण: जब हम पसीना बहाते हैं, तो वह त्वचा से वाष्पित होकर हमारी त्वचा से गर्मी को खींच लेता है, जिससे हमें ठंडक महसूस होती है।
- गीले कपड़ों से हवा लगने पर ठंडक: गीले कपड़ों से पानी वाष्पित होता है और शरीर की गर्मी को सोखता है। इसीलिए तेज हवा में गीले कपड़े पहनने पर ठंड लगती है।
- डेज़र्ट कूलर का सिद्धांत: कूलर में पानी वाष्पित होकर कमरे की गर्मी को सोखता है और ठंडी हवा प्रदान करता है।
वाष्पीकरण के कारण शीतलता का सिद्धांत हमारे शरीर के तापमान को नियंत्रित रखने में महत्वपूर्ण भूमिका निभाता है।
वाष्पीकरण और ताप से जुड़े महत्वपूर्ण प्रश्नोत्तर/ पदार्थ की प्रकृति
उत्तर: क्योंकि गर्म और शुष्क वातावरण में वाष्पीकरण की दर अधिक होती है। कूलर में पानी तेजी से वाष्पित होता है और वह अधिक मात्रा में गर्मी को सोख लेता है, जिससे हवा ठंडी हो जाती है।
उत्तर: घड़े की मिट्टी में छोटे-छोटे छिद्र होते हैं जिनसे पानी धीरे-धीरे बाहर आता है और वाष्पित हो जाता है। वाष्पीकरण के दौरान वह गर्मी को घड़े से सोख लेता है, जिससे घड़े का जल ठंडा हो जाता है।
उत्तर: ये पदार्थ अत्यधिक उड़नशील होते हैं और त्वचा पर डालते ही तेजी से वाष्पित हो जाते हैं। वाष्पीकरण के लिए यह हमारी हथेली की गर्मी को सोखते हैं, जिससे हथेली ठंडी महसूस होती है।
उत्तर: प्लेट की सतह चौड़ी होती है, जिससे वाष्पीकरण और ताप का अपवहन (heat loss) अधिक होता है। इसलिए चाय या दूध जल्दी ठंडा हो जाता है और उसे जल्दी पी सकते हैं।
उत्तर: गर्मियों में हल्के रंग के, सूती और ढीले कपड़े पहनने चाहिए क्योंकि ये पसीने को अवशोषित कर जल्दी वाष्पित करते हैं और शरीर को ठंडा रखते हैं। हल्के रंग सूर्य की गर्मी को कम अवशोषित करते हैं।
आपने क्या सीखा
- द्रव्य सूक्ष्म कणों से मिलकर बना होता है।
- हमारे आस-पास द्रव्य तीन अवस्थाओं में विद्यमान होता है: ठोस, द्रव और गैस।
- ठोस के कणों में आकर्षण बल सबसे अधिक, गैस के कणों में सबसे कम और द्रव के कणों में दोनों के मध्यवर्ती होते हैं।
- ठोस के कणों में घनत्व अधिक होता है, जबकि गैस में न्यूनतम और द्रव में मध्यम होता है।
- ठोस की आकृति और आयतन नियत होता है, द्रव की आकृति बदल सकती है और गैस किसी भी बर्तन को पूरा भर सकती है।
- पदार्थ अपनी अवस्था बदल सकते हैं जैसे ठोस → द्रव → गैस और इसके विपरीत।
- ऊष्मीय ऊर्जा और दाब में परिवर्तन से अवस्था परिवर्तन संभव होता है।
- उर्ध्वपातन में ठोस पदार्थ सीधे गैस में परिवर्तित हो जाता है।
- संपृक्त वाष्पावस्था में सतह के कण द्रव अवस्था से वाष्प में बदल जाते हैं।
- वाष्पीकरण सतह की प्रक्रिया है जो ताप, सतह क्षेत्रफल, वायु की गति और आर्द्रता पर निर्भर करती है।
- वाष्पीकरण के कारण शीतलता महसूस होती है क्योंकि यह ऊष्मा का अवशोषण करता है।
- गुप्त ऊष्मा वह ऊर्जा है जो किसी द्रव्य को उसकी अवस्था बदले बिना गर्म या ठंडा करती है।
कुछ मापनीय राशियाँ और उनके मात्रक
| राशि | मात्रक | प्रतीक |
|---|---|---|
| तापमान | केल्विन | K |
| लंबाई | मीटर | m |
| संपत्ति | किलोग्राम | kg |
| भार | न्यूटन | N |
| आयतन | घन मीटर | m³ |
| घनत्व | किलोग्राम प्रति घनमीटर | kg·m⁻³ |
| दाब | पास्कल | Pa |
अभ्यास प्रश्न: हमारे आस-पास के पदार्थ / पदार्थ की प्रकृति
- निम्नलिखित तापमानों को सेल्सियस इकाई में परिवर्तित करें:
(a) 300 K = 300 – 273 = 27°C
(b) 573 K = 573 – 273 = 300°C - निम्नलिखित तापमानों को केल्विन इकाई में परिवर्तित करें:
(a) 25°C = 25 + 273 = 298 K
(b) 373°C = 373 + 273 = 646 K - निम्नलिखित अवलोकनों हेतु कारण लिखें:
(a) नेफ्थलीन को खुला रखने पर यह बिना कुछ छोड़े अदृश्य हो जाती है:
नेफ्थलीन उर्ध्वपातन द्वारा सीधे ठोस से गैस में बदल जाती है।(b) इत्र की गंध दूर बैठे हुए भी महसूस होती है:
इत्र की गंध वाले अणु हवा में फैलकर दूर तक पहुँचते हैं। यह विसरण (diffusion) के कारण होता है। - निम्नलिखित पदार्थों को उनके कणों के बीच बढ़ते हुए आकर्षण के अनुसार व्यवस्थित करें:
(a) जल (b) चीनी (c) ऑक्सीजन
उत्तर: ऑक्सीजन < जल < चीनी
(गैस < द्रव < ठोस के आधार पर) - निम्नलिखित तापमानों पर जल की भौतिक अवस्था क्या है?
(a) 25°C → द्रव
(b) 0°C → ठोस (बर्फ़) और द्रव (पिघलने पर)
(c) 100°C → द्रव और गैस (उबालने पर) - पुष्टि हेतु कारण दें:
(a) जल कमरे के ताप पर द्रव है:
क्योंकि कमरे का ताप 25°C होता है, जो कि जल के 0°C से 100°C के बीच है, जहाँ वह द्रव होता है।(b) लोहे की अलमारी कमरे के ताप पर ठोस है:
क्योंकि लोहे का गलनांक बहुत अधिक (लगभग 1500°C) होता है। इसलिए कमरे के तापमान पर वह ठोस रहता है। - 273 K पर बर्फ़ को ठंडा करने और जल को ठंडा करने में किसमें अधिक शीतलता महसूस होती है?
उत्तर: बर्फ़ को, क्योंकि वह पिघलने के लिए ऊष्मा को अवशोषित करती है (गुप्त ऊष्मा)। इसी कारण शीतलता अधिक होती है। - उबलते हुए जल अथवा भाप में से जलने की तीव्रता किसमें अधिक होती है?
उत्तर: भाप में, क्योंकि उसमें अतिरिक्त गुप्त ऊष्मा होती है जो त्वचा को अधिक जलाती है। - निम्नलिखित चित्र में A, B, C, D, E, F को नामांकित करें:
प्रतीक अवस्था परिवर्तन A पिघलना (Melting) B संघनन (Condensation) C वाष्पीकरण (Evaporation) D जमना (Freezing) E उर्ध्वपातन (Sublimation) F पुनः संघनन (Deposition)
समूह हेतु क्रियाकलाप:
ठोसों, द्रवों और गैसों में कणों की गतिशीलता दर्शाने के लिए पारदर्शी जार की मदद से एक प्रदर्श मॉडल बनाएँ। यह विद्यार्थियों को अवस्थाओं की समझ विकसित करने में मदद करेगा। पदार्थ की प्रकृति की समझ को विकसित करें।
पदार्थों की अवस्थाएँ – टॉप 20 MCQ
- पदार्थ की तीन मुख्य अवस्थाएँ कौन-कौन सी हैं?
A. ठोस, द्रव, गैस
B. ठोस, गैस, प्लाज्मा
C. द्रव, गैस, प्लाज्मा
D. गैस, प्लाज्मा, बोस-आइंस्टीन
उत्तर: A. ठोस, द्रव, गैस - निम्न में से कौन-सा ठोस पदार्थ नहीं है?
A. बर्फ
B. लकड़ी
C. ऑक्सीजन
D. लोहा
उत्तर: C. ऑक्सीजन - गैसों में अणु किस प्रकार गति करते हैं?
A. एक स्थान पर स्थिर रहते हैं
B. केवल कंपन करते हैं
C. एक-दूसरे से टकराते हुए स्वतंत्र रूप से गति करते हैं
D. कोई गति नहीं करते
उत्तर: C. एक-दूसरे से टकराते हुए स्वतंत्र रूप से गति करते हैं - द्रव में अणु किस प्रकार गति करते हैं?
A. बहुत तेजी से
B. हिलते हुए और एक-दूसरे पर फिसलते हुए
C. स्थिर रहते हैं
D. केवल नीचे की ओर गिरते हैं
उत्तर: B. हिलते हुए और एक-दूसरे पर फिसलते हुए - जब कोई ठोस द्रव में बदलता है तो इस प्रक्रिया को क्या कहते हैं?
A. वाष्पीकरण
B. द्रवीकरण
C. संघनन
D. उर्ध्वपातन
उत्तर: B. द्रवीकरण - निम्न में से कौन-सा कारक वाष्पीकरण को प्रभावित करता है?
A. सतह क्षेत्र
B. तापमान
C. वायु प्रवाह
D. उपरोक्त सभी
उत्तर: D. उपरोक्त सभी - दाब बढ़ाने से पदार्थ की कौन-सी अवस्था बनती है?
A. गैस
B. द्रव
C. ठोस
D. कोई नहीं
उत्तर: C. ठोस - वाष्पीकरण के कारण शीतलता क्यों होती है?
A. ताप बढ़ता है
B. वाष्पीकरण ऊष्मा अवशोषित करता है
C. वाष्पीकरण में ऊष्मा निकलती है
D. हवा ठंडी होती है
उत्तर: B. वाष्पीकरण ऊष्मा अवशोषित करता है - ठोस अवस्था की विशेषता क्या है?
A. निश्चित आकार और आयतन
B. कोई आकार नहीं
C. आकार बर्तन के अनुसार
D. तरलता
उत्तर: A. निश्चित आकार और आयतन - वाष्पन को बढ़ाने के लिए कौन-सी परिस्थिति उचित है?
A. नमी भरा वातावरण
B. तेज हवा
C. कम सतह क्षेत्र
D. कम तापमान
उत्तर: B. तेज हवा - गैसें किसमें परिवर्तित की जा सकती हैं?
A. केवल द्रव
B. केवल ठोस
C. द्रव और ठोस दोनों
D. कोई नहीं
उत्तर: C. द्रव और ठोस दोनों - ठोस पदार्थों के कणों के बीच अंतर कैसा होता है?
A. बहुत कम
B. बहुत अधिक
C. मध्यम
D. कोई नहीं
उत्तर: A. बहुत कम - निम्नलिखित में से कौन-सी प्रक्रिया में गैस सीधे ठोस में बदलती है?
A. वाष्पीकरण
B. संघनन
C. उर्ध्वपातन
D. शमन
उत्तर: D. शमन - उबलने का बिंदु किससे प्रभावित होता है?
A. द्रव के घनत्व से
B. दाब से
C. सतह क्षेत्र से
D. रंग से
उत्तर: B. दाब से - पदार्थ के कणों में लगातार गति का प्रमाण क्या है?
A. उनके आकार
B. उनके रंग
C. ब्राउनियन गति
D. संघनन
उत्तर: C. ब्राउनियन गति - किस अवस्था में कणों के बीच आकर्षण बल सबसे अधिक होता है?
A. गैस
B. द्रव
C. ठोस
D. प्लाज्मा
उत्तर: C. ठोस - संघनन किसे कहते हैं?
A. द्रव से गैस बनना
B. ठोस से द्रव बनना
C. गैस से द्रव बनना
D. ठोस से गैस बनना
उत्तर: C. गैस से द्रव बनना - निम्न में से कौन वाष्पन के उदाहरण नहीं हैं?
A. हवा में कपड़ों का सूखना
B. बर्तन से पानी का उबलना
C. बर्फ का पिघलना
D. इत्र की खुशबू फैलना
उत्तर: C. बर्फ का पिघलना - जब कोई तरल गैस में बदली जाती है तो क्या होता है?
A. दाब बढ़ता है
B. आयतन बढ़ता है
C. ऊर्जा घटती है
D. घनत्व घटता है
उत्तर: C. ऊर्जा घटती है - पानी का वाष्पन सबसे अधिक कब होता है?
A. ठंडे और नम दिन में
B. गर्म और शुष्क दिन में
C. रात को
D. सुबह जल्दी
उत्तर: B. गर्म और शुष्क दिन में
Class 10 Science all chapter notes
Chapter – 1- रासायनिक अभिक्रियाएं एवं समीकरण
Chapter – 2- अम्ल, क्षार एवं लवण
Chapter – 3 – धातु एवं अधातु
Chapter – 4 – कार्बन एवं उसके यौगिक
Chapter – 5 – जैव प्रक्रम
Chapter – 6 – नियंत्रण एवं समन्वय
Chapter – 7 – जीव जनन कैसे करते हैं
Chapter – 8 – आनुवांशिकता और जैव विकास
Chapter – 9 – प्रकाश का परावर्तन एवं अपवर्तन
Chapter – 10 – मानव नेत्र एवं रंग बिरंगा संसार
Chapter – 11 – विद्युत
Chapter – 12 – विद्युत धारा का चुंबकीय प्रभाव
Chapter – 13 – हमारा पर्यावरण
अन्य श्रोत:-
