इस पाठ में हम परमाणु की संरचना class 9 के बारे में विस्तृत जानकारी प्राप्त करेंगे।
अध्याय 4: परमाणु की संरचना
हर पदार्थ अणुओं और परमाणुओं से बना है, लेकिन इन परमाणुओं की आंतरिक संरचना क्या होती है? क्या वे ठोस कण होते हैं या उनके भीतर भी कुछ और कण होते हैं? इस अध्याय में हम जानेंगे कि परमाणु के अंदर क्या होता है और कैसे वैज्ञानिकों ने इसके रहस्य को धीरे-धीरे उजागर किया।
परमाणु शब्द ‘Atomos’ से आया है जिसका अर्थ है — जिसे और विभाजित नहीं किया जा सकता। लेकिन आधुनिक खोजों ने यह सिद्ध कर दिया कि परमाणु भी विभाज्य है और इसके अंदर इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन जैसे कण होते हैं।
इस अध्याय में आप जानेंगे:
- डॉल्टन के परमाणु सिद्धांत की विशेषताएं
- इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन की खोज कैसे हुई?
- थॉमसन, रदरफोर्ड और बोहर के परमाणु मॉडल
- परमाणु संख्या, द्रव्यमान संख्या और समस्थानिक
- परमाणु की आधुनिक संरचना और आवेश वितरण
इस अध्याय का उद्देश्य छात्रों को परमाणु की भीतरी संरचना के बारे में वैज्ञानिक अवधारणाओं के साथ परिचित कराना है, जिससे वे पदार्थों की प्रकृति को बेहतर ढंग से समझ सकें।
पदार्थों के आवेशित कण
प्रारंभ में यह माना जाता था कि परमाणु अविभाज्य होते हैं, लेकिन वैज्ञानिक प्रयोगों ने यह स्पष्ट कर दिया कि परमाणु के अंदर भी कई छोटे-छोटे कण होते हैं। इनमें कुछ कण आवेशित (charged) होते हैं। पदार्थों के ये आवेशित कण पदार्थ की विद्युत प्रकृति को समझने में हमारी सहायता करते हैं।
विद्युत आवेश वाले कणों की खोज ने परमाणु भौतिकी की दिशा ही बदल दी। सबसे पहले विद्युत आवेश के दो प्रकार – धनावेश (Positive) और ऋणावेश (Negative) – की पहचान की गई।
मुख्य आवेशित कण:
- इलेक्ट्रॉन (Electron): ऋणात्मक आवेशित कण, जिसकी खोज जे. जे. थॉमसन ने 1897 में की।
- प्रोटॉन (Proton): धनात्मक आवेशित कण, जिसकी खोज गोल्डस्टीन द्वारा की गई और विस्तृत अध्ययन रदरफोर्ड ने किया।
- न्यूट्रॉन (Neutron): यह विद्युत रूप से उदासीन (Neutral) होता है, जिसकी खोज जेम्स चैडविक ने की थी।
केवल इलेक्ट्रॉन और प्रोटॉन ही आवेशित कण होते हैं। न्यूट्रॉन में कोई आवेश नहीं होता है। इलेक्ट्रॉन परमाणु के बाहर कक्षा में होते हैं जबकि प्रोटॉन और न्यूट्रॉन नाभिक में स्थित होते हैं।
विद्युत रूप से उदासीन परमाणु
जब किसी परमाणु में प्रोटॉन और इलेक्ट्रॉन की संख्या समान होती है, तो वह विद्युत रूप से उदासीन होता है, अर्थात उसका कुल आवेश शून्य होता है। लेकिन यदि यह संतुलन बिगड़ जाए तो आयन बनते हैं।
परमाणु के कणों की जानकारी
| कण | खोजकर्ता | खोज वर्ष | आवेश | द्रव्यमान (amu) | प्रमुख स्थान |
|---|---|---|---|---|---|
| इलेक्ट्रॉन (Electron) | जे. जे. थॉमसन | 1897 | -1 | 1/1837 | परमाणु के बाहर (कक्षा में) |
| प्रोटॉन (Proton) | आर्नेस्ट रदरफोर्ड | 1917 | +1 | 1 | नाभिक में |
| न्यूट्रॉन (Neutron) | जेम्स चैडविक | 1932 | 0 | 1 | नाभिक में |
1. केनाल किरणें क्या हैं?
उत्तर: केनाल किरणें (Canal Rays) धनावेशित कणों की किरणें होती हैं जो गैस से भरे कैथोड किरण नलिका (Cathode Ray Tube) में कैथोड की ओर चलती हैं। इनका नाम केनाल किरणें इसलिए पड़ा क्योंकि ये कैथोड में बने छोटे-छोटे छिद्रों (canals) से होकर निकलती हैं। इन किरणों की खोज गोल्डस्टीन ने की थी और इन्हीं किरणों से प्रोटॉन की खोज हुई।
2. यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं?
उत्तर: नहीं, ऐसे परमाणु में कोई शुद्ध आवेश नहीं होगा। ऐसा परमाणु विद्युत-तटस्थ होता है क्योंकि प्रोटॉन का धनात्मक आवेश और इलेक्ट्रॉन का ऋणात्मक आवेश एक-दूसरे को संतुलित कर देते हैं।
परमाणु की संरचना
परमाणु वह सूक्ष्मतम कण होता है जिससे सभी पदार्थ बने होते हैं। यह तीन प्रमुख उपकणों से मिलकर बना होता है – इलेक्ट्रॉन (electron), प्रोटॉन (proton) और न्यूट्रॉन (neutron)। इन उपकणों की खोज वैज्ञानिकों ने अलग-अलग समय पर की थी।
उपकणों की खोज:
- इलेक्ट्रॉन की खोज – जे. जे. थॉमसन ने 1897 में की।
- प्रोटॉन की खोज – ई. गोल्डस्टीन ने 1886 में की और इसे नाम रदरफोर्ड ने दिया।
- न्यूट्रॉन की खोज – जेम्स चैडविक ने 1932 में की।
परमाणु के कणों की तुलना
| कण | खोजकर्ता | आवेश | द्रव्यमान | स्थिति |
|---|---|---|---|---|
| इलेक्ट्रॉन | जे. जे. थॉमसन | -1 | 9.1 × 10⁻³¹ kg | नाभिक के बाहर |
| प्रोटॉन | गोल्डस्टीन | +1 | 1.672 × 10⁻²⁷ kg | नाभिक के अंदर |
| न्यूट्रॉन | जेम्स चैडविक | 0 | 1.675 × 10⁻²⁷ kg | नाभिक के अंदर |
महत्वपूर्ण तथ्य:
- इलेक्ट्रॉन हल्का होता है, इसका द्रव्यमान प्रोटॉन का लगभग 1/1836 होता है।
- परमाणु के केंद्र में स्थित नाभिक (nucleus) में प्रोटॉन और न्यूट्रॉन होते हैं।
- नाभिक धनावेशित होता है क्योंकि उसमें प्रोटॉन होते हैं।
- इलेक्ट्रॉन नाभिक के चारों ओर ऊर्जा स्तरों में परिक्रमा करते हैं।
परमाणु की संपूर्ण संरचना:
प्रत्येक परमाणु का एक नाभिक होता है, जिसमें प्रोटॉन और न्यूट्रॉन होते हैं। नाभिक के चारों ओर इलेक्ट्रॉन परिक्रमा करते हैं। ये इलेक्ट्रॉन अलग-अलग ऊर्जा स्तरों या कोशों (shells) में रहते हैं। परमाणु समग्र रूप से स्थिर होता है क्योंकि उसमें धनावेश (प्रोटॉन) और ऋणावेश (इलेक्ट्रॉन) की संख्या बराबर होती है।
यदि किसी परमाणु में इलेक्ट्रॉनों और प्रोटॉनों की संख्या समान होती है, तो उसका कुल आवेश शून्य होता है और वह एक उदासीन (neutral) परमाणु कहलाता है।
इस प्रकार, परमाणु की संरचना यह दर्शाती है कि पदार्थ की मूल इकाई कितनी जटिल और अद्भुत होती है।
टॉमसन का परमाणु मॉडल
टॉमसन ने सन् 1897 में इलेक्ट्रॉन की खोज की। उन्होंने परमाणु की संरचना को समझाने के लिए एक मॉडल प्रस्तुत किया जिसे ‘किशमिश पुडिंग मॉडल’ (Plum Pudding Model) कहा गया।
मुख्य विशेषताएँ:
- परमाणु एक धनावेशित गोला होता है जिसमें ऋणावेशित इलेक्ट्रॉन छिपे रहते हैं।
- धनावेशित पृष्ठभूमि में इलेक्ट्रॉन ऐसे स्थित रहते हैं जैसे किशमिश पुडिंग में किशमिश।
- परमाणु में कुल आवेश न्यूट्रल होता है क्योंकि धनावेश और ऋणावेश एक-दूसरे को संतुलित कर लेते हैं।
टॉमसन के मॉडल के अनुसार, परमाणु में इलेक्ट्रॉन स्थिर रूप से फैले हुए होते हैं। यह मॉडल उस समय के लिए उपयोगी था, लेकिन आगे चलकर रदरफोर्ड के प्रयोगों ने इसे गलत सिद्ध किया।
रदरफोर्ड का परमाणु मॉडल
रदरफोर्ड ने 1911 में अपने प्रसिद्ध स्वर्ण पन्नी प्रकीर्णन प्रयोग के आधार पर परमाणु की रचना के बारे में नया मॉडल प्रस्तुत किया। इस प्रयोग में उन्होंने अल्फा कणों को पतली सोने की पन्नी पर गिराया और उनके प्रकीर्णन की दिशा का अवलोकन किया।
प्रयोग से अवलोकन:
- अधिकांश अल्फा कण बिना किसी विक्षेप के सीधे निकल गए।
- कुछ अल्फा कण थोड़ा विक्षेपित हुए।
- बहुत कम अल्फा कण पूर्णतः पीछे लौट गए।
इन परिणामों के आधार पर रदरफोर्ड ने निम्नलिखित निष्कर्ष निकाले:
| बिंदु | रदरफोर्ड के निष्कर्ष |
|---|---|
| 1. परमाणु का अधिकांश भाग रिक्त है | क्योंकि अधिकांश अल्फा कण बिना विक्षेप के निकल गए। |
| 2. परमाणु का केंद्रक धनावेशित होता है | क्योंकि कुछ कण विक्षेपित हुए और कुछ लौट गए। |
| 3. केंद्रक में परमाणु का लगभग पूरा द्रव्यमान केंद्रित होता है | जो कि बहुत छोटा और घना होता है। |
| 4. इलेक्ट्रॉन नाभिक के चारों ओर घूमते हैं | वे स्थिर कक्षाओं में घूमते हैं, जैसे ग्रह सूर्य के चारों ओर। |
रदरफोर्ड मॉडल की सीमाएँ:
- इलेक्ट्रॉन नाभिक के चारों ओर घूमते हुए ऊर्जा विकीर्ण करेंगे और अंततः नाभिक में गिर जाएंगे, जो कि वास्तव में नहीं होता।
- यह मॉडल परमाणु की स्थिरता को स्पष्ट नहीं कर सका।
टामसन और रदरफोर्ड का परमाणु मॉडल
टामसन के अनुसार, परमाणु एक धनात्मक गोला है जिसमें नकारात्मक इलेक्ट्रॉन कणों की तरह फैले होते हैं। जैसे प्लम पुडिंग में किशमिश होती हैं, वैसे ही इस मॉडल में इलेक्ट्रॉन होते हैं।
रदरफोर्ड के अनुसार, परमाणु का अधिकांश भाग रिक्त होता है। परमाणु के केंद्र में एक धनात्मक नाभिक होता है जिसके चारों ओर इलेक्ट्रॉन परिक्रमा करते हैं, जैसे ग्रह सूर्य के चारों ओर।
टामसन और रदरफोर्ड मॉडल की तुलना:
| तुलना बिंदु | टामसन मॉडल | रदरफोर्ड मॉडल |
|---|---|---|
| प्रस्ताव वर्ष | 1897 | 1911 |
| मुख्य विशेषता | धनात्मक गोला जिसमें इलेक्ट्रॉन फैले हैं | नाभिक के चारों ओर इलेक्ट्रॉन परिक्रमा करते हैं |
| अनुरूपता | प्लम पुडिंग मॉडल | सौर मंडल मॉडल |
| रिक्त स्थान | नहीं बताया | अधिकांश परमाणु रिक्त होता है |
| नाभिक की जानकारी | नहीं | हां, केंद्र में नाभिक होता है |
बोर का परमाण्विक मॉडल
सन 1913 में नील्स बोर ने रदरफोर्ड के परमाणु मॉडल में सुधार करते हुए एक नया परमाणु मॉडल प्रस्तुत किया, जिसे बोर का परमाणु मॉडल कहा जाता है। यह मॉडल परमाणु के इलेक्ट्रॉनों की स्थितियों और ऊर्जा स्तरों को स्पष्ट रूप से समझाने में सहायक था।
बोर मॉडल की प्रमुख विशेषताएँ:
- इलेक्ट्रॉन केवल निश्चित ऊर्जा स्तरों में ही घूम सकते हैं, जिन्हें K, L, M, N… आदि कहा जाता है।
- इलेक्ट्रॉन अपनी कक्षा में ऊर्जा का उत्सर्जन या अवशोषण नहीं करता।
- जब इलेक्ट्रॉन एक कक्षा से दूसरी कक्षा में जाता है, तो वह ऊर्जा का उत्सर्जन या अवशोषण करता है।
- नाभिक की ओर आकर्षण और इलेक्ट्रॉन की गति में संतुलन होने पर ही वह स्थिर कक्षा में बना रहता है।
बोर का मॉडल हाइड्रोजन जैसे एक इलेक्ट्रॉन वाले परमाणुओं के व्यवहार को अच्छी तरह समझा सकता है, लेकिन यह बहु-इलेक्ट्रॉन वाले परमाणुओं के लिए पूरी तरह से उपयुक्त नहीं था।
महत्वपूर्ण प्रश्नोत्तर : परमाणु की संरचना
प्रश्न 1: परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर: टॉमसन के मॉडल के अनुसार, परमाणु एक धनावेशित गोले के समान है जिसमें ऋणावेशित इलेक्ट्रॉन समान रूप से फैले होते हैं। धनात्मक आवेश की मात्रा, इलेक्ट्रॉनों के ऋणात्मक आवेश के बराबर होती है। इस प्रकार, परमाणु में कुल आवेश शून्य होता है, इसलिए परमाणु उदासीन होता है।
प्रश्न 2: रदरफ़ोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन सा अवपरमाणुक कण विद्यमान है?
उत्तर: रदरफ़ोर्ड के मॉडल के अनुसार, परमाणु के नाभिक में मुख्यतः प्रोटॉन पाए जाते हैं, जो धनावेशित होते हैं। बाद में यह ज्ञात हुआ कि नाभिक में एक अन्य कण न्यूट्रॉन भी उपस्थित होता है, जो उदासीन होता है।
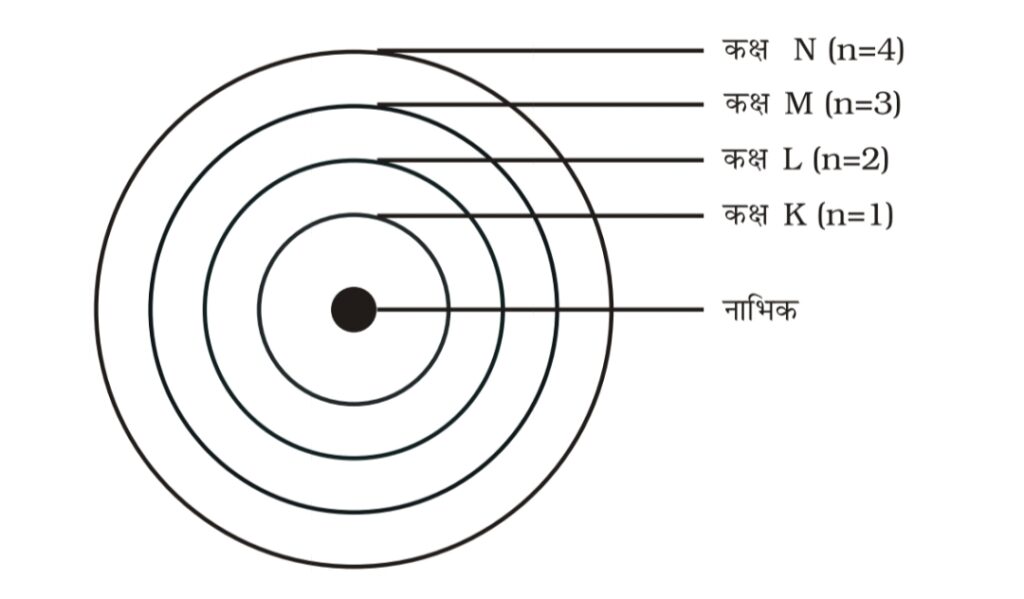
प्रश्न 3: तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए:
उत्तर: नीचे तीन कक्षाओं (K, L, M) वाले बोर मॉडल का चित्र दिया गया है:
 यह मॉडल दर्शाता है कि इलेक्ट्रॉन विशिष्ट कक्षाओं में नाभिक के चारों ओर परिक्रमा करते हैं।
यह मॉडल दर्शाता है कि इलेक्ट्रॉन विशिष्ट कक्षाओं में नाभिक के चारों ओर परिक्रमा करते हैं।
प्रश्न 4: क्या अल्फ़ा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा?
उत्तर: हाँ, यह प्रयोग अन्य धातु की पतली पन्नियों जैसे चाँदी या तांबे से भी किया जा सकता है। परंतु सोने की पन्नी को चुना गया क्योंकि यह बहुत पतली बनाई जा सकती है और अधिक सुगमता से प्रकीर्णन को दर्शाती है।
न्यूट्रॉन (Neutron)
न्यूट्रॉन एक विद्युत उदासीन (Neutral) अवपरमाण्विक कण होता है, जिसका कोई आवेश नहीं होता। यह मुख्यतः परमाणु के नाभिक (Nucleus) में पाया जाता है।
न्यूट्रॉन की प्रमुख विशेषताएँ
- न्यूट्रॉन का कोई आवेश नहीं होता।
- यह परमाणु के नाभिक में उपस्थित होता है।
- न्यूट्रॉन का द्रव्यमान लगभग 1 a.m.u (1.675 × 10-27 kg) होता है, जो प्रोटॉन के द्रव्यमान के लगभग बराबर होता है।
- नाभिक में न्यूट्रॉन और प्रोटॉन मिलकर न्यूक्लिऑन कहलाते हैं।
| गुण | विवरण |
|---|---|
| नाम | न्यूट्रॉन |
| खोजकर्ता | जेम्स चैडविक (1932) |
| आवेश | 0 (उदासीन) |
| द्रव्यमान | 1.675 × 10-27 kg (लगभग 1 a.m.u) |
| स्थिति | परमाणु के नाभिक में |
न्यूट्रॉन का जीवनकाल स्वतंत्र अवस्था में लगभग 15 मिनट होता है। उसके बाद यह एक प्रोटॉन, इलेक्ट्रॉन और एंटी-न्यूट्रिनो में बदल जाता है।
विभिन्न कक्षाओं में इलेक्ट्रॉन का वितरण
परमाणु के भीतर इलेक्ट्रॉन एक साथ केंद्र में नहीं रहते, बल्कि ये कक्षाओं (shells) या ऊर्जा स्तरों (energy levels) में वितरित होते हैं। इन कक्षाओं को K, L, M, N आदि नाम दिए गए हैं, जो केंद्र (नाभिक) से दूरी के क्रम में होते हैं।
किसी भी कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या 2n² होती है, जहाँ n उस कक्षा का क्रमांक (n = 1, 2, 3, …) होता है।
विभिन्न कक्षाओं की अधिकतम क्षमता:
| कक्षा (Shell) | कक्षा संख्या (n) | अधिकतम इलेक्ट्रॉन |
|---|---|---|
| K | 1 | 2 |
| L | 2 | 8 |
| M | 3 | 18 |
| N | 4 | 32 |
उदाहरण:
- हाइड्रोजन (Atomic no. = 1): K में 1 इलेक्ट्रॉन → K = 1
- कार्बन (Atomic no. = 6): K = 2, L = 4 → 2, 4
- सोडियम (Atomic no. = 11): K = 2, L = 8, M = 1 → 2, 8, 1
1 से 20 तक के तत्वों का इलेक्ट्रॉनिक विन्यास
| क्रमांक | तत्व का नाम | प्रतीक | परमाणु क्रमांक | इलेक्ट्रॉनिक विन्यास |
|---|---|---|---|---|
| 1 | हाइड्रोजन | H | 1 | 1 |
| 2 | हीलियम | He | 2 | 2 |
| 3 | लिथियम | Li | 3 | 2,1 |
| 4 | बेरिलियम | Be | 4 | 2,2 |
| 5 | बोरॉन | B | 5 | 2,3 |
| 6 | कार्बन | C | 6 | 2,4 |
| 7 | नाइट्रोजन | N | 7 | 2,5 |
| 8 | ऑक्सीजन | O | 8 | 2,6 |
| 9 | फ्लोरीन | F | 9 | 2,7 |
| 10 | निऑन | Ne | 10 | 2,8 |
| 11 | सोडियम | Na | 11 | 2,8,1 |
| 12 | मैग्नीशियम | Mg | 12 | 2,8,2 |
| 13 | एल्युमिनियम | Al | 13 | 2,8,3 |
| 14 | सिलिकॉन | Si | 14 | 2,8,4 |
| 15 | फॉस्फोरस | P | 15 | 2,8,5 |
| 16 | सल्फर | S | 16 | 2,8,6 |
| 17 | क्लोरीन | Cl | 17 | 2,8,7 |
| 18 | आर्गन | Ar | 18 | 2,8,8 |
| 19 | पोटैशियम | K | 19 | 2,8,8,1 |
| 20 | कैल्शियम | Ca | 20 | 2,8,8,2 |
परमाणु के अवपरमाणुक कण और हीलियम में न्यूट्रॉन की संख्या
| क्रमांक | कण का नाम | प्रतीक | आवेश | द्रव्यमान (kg) |
|---|---|---|---|---|
| 1 | प्रोटॉन | p⁺ | +1 | 1.6726 × 10-27 |
| 2 | न्यूट्रॉन | n⁰ | 0 | 1.6750 × 10-27 |
| 3 | इलेक्ट्रॉन | e⁻ | -1 | 9.1093 × 10-31 |
उत्तर:
- हीलियम का परमाणु द्रव्यमान (Mass Number) = 4
- प्रोटॉन की संख्या = 2
- न्यूट्रॉन की संख्या = परमाणु द्रव्यमान – प्रोटॉन की संख्या = 4 – 2 = 2
1. कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन-वितरण लिखिए:
परमाणु क्रमांक = 6
इलेक्ट्रॉन-वितरण: K = 2, L = 4
परमाणु क्रमांक = 11
इलेक्ट्रॉन-वितरण: K = 2, L = 8, M = 1
2. अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी?
K कोश में अधिकतम 2 इलेक्ट्रॉन होते हैं।
L कोश में अधिकतम 8 इलेक्ट्रॉन होते हैं।
यदि दोनों कोश पूरी तरह भरे हैं, तो इलेक्ट्रॉनों की कुल संख्या होगी:
2 + 8 = 10
संयोजकता (Valency) क्या होती है?
संयोजकता का निर्धारण कैसे होता है?
किसी तत्व की संयोजकता उसके आवरण (valence shell) में उपस्थित इलेक्ट्रॉनों की संख्या</strong पर निर्भर करती है।
- अगर बाह्य कक्षा में 1, 2 या 3 इलेक्ट्रॉन होते हैं, तो तत्व वे देकर संयोजकता दिखाते हैं।
- अगर बाह्य कक्षा में 5, 6 या 7 इलेक्ट्रॉन होते हैं, तो तत्व वे लेकर संयोजकता दिखाते हैं।
- अगर बाह्य कक्षा में 4 इलेक्ट्रॉन होते हैं, तो वह साझा</strong करता है।
उदाहरणों के साथ समझें:
| तत्व | परमाणु क्रमांक | इलेक्ट्रॉन वितरण | बाह्य इलेक्ट्रॉन | संयोजकता |
|---|---|---|---|---|
| हाइड्रोजन (H) | 1 | 1 | 1 | 1 |
| ऑक्सीजन (O) | 8 | 2, 6 | 6 | 2 |
| कार्बन (C) | 6 | 2, 4 | 4 | 4 |
| सोडियम (Na) | 11 | 2, 8, 1 | 1 | 1 |
कुछ महत्वपूर्ण तथ्य:
- किसी तत्व की संयोजकता यह दर्शाती है कि वह कितने अन्य परमाणुओं से जुड़ सकता है।
- सामान्यतः संयोजकता = 8 − बाह्य इलेक्ट्रॉनों की संख्या
- हीलियम, निऑन, आर्गन जैसे गैसों की संयोजकता 0 होती है क्योंकि इनकी बाहरी कक्षा पूर्ण होती है।
विभिन्न शैलों में इलेक्ट्रॉनों के वितरण के साथ पहले अठारह तत्वों के परमाणुओं का संयोजन
| तत्व का नाम | प्रतीक | परमाणु संख्या | प्रोटॉनों की संख्या | न्यूट्रॉनों की संख्या | इलेक्ट्रॉनों की संख्या | K | L | M | संयोजकता |
|---|---|---|---|---|---|---|---|---|---|
| हाइड्रोजन | H | 1 | 1 | – | 1 | 1 | – | – | 1 |
| हीलियम | He | 2 | 2 | 2 | 2 | 2 | – | – | 0 |
| लिथियम | Li | 3 | 3 | 4 | 3 | 2 | 1 | – | 1 |
| बेरेलियम | Be | 4 | 4 | 5 | 4 | 2 | 2 | – | 2 |
| बोरॉन | B | 5 | 5 | 6 | 5 | 2 | 3 | – | 3 |
| कार्बन | C | 6 | 6 | 6 | 6 | 2 | 4 | – | 4 |
| नाइट्रोजन | N | 7 | 7 | 7 | 7 | 2 | 5 | – | 3 |
| ऑक्सीजन | O | 8 | 8 | 8 | 8 | 2 | 6 | – | 2 |
| फ्लोरीन | F | 9 | 9 | 10 | 9 | 2 | 7 | – | 1 |
| निऑन | Ne | 10 | 10 | 10 | 10 | 2 | 8 | – | 0 |
| सोडियम | Na | 11 | 11 | 12 | 11 | 2 | 8 | 1 | 1 |
| मैग्नीशियम | Mg | 12 | 12 | 12 | 12 | 2 | 8 | 2 | 2 |
| ऐलुमिनियम | Al | 13 | 13 | 14 | 13 | 2 | 8 | 3 | 3 |
| सिलिकॉन | Si | 14 | 14 | 14 | 14 | 2 | 8 | 4 | 4 |
| फॉस्फोरस | P | 15 | 15 | 16 | 15 | 2 | 8 | 5 | 3 |
| सल्फर | S | 16 | 16 | 16 | 16 | 2 | 8 | 6 | 2 |
| क्लोरीन | Cl | 17 | 17 | 18 | 17 | 2 | 8 | 7 | 1 |
| आर्गन | Ar | 18 | 18 | 22 | 18 | 2 | 8 | 8 | 0 |
परमाणु संख्या ज्ञात करने की विधि
**परमाणु संख्या (Atomic Number)** किसी तत्व के परमाणु में उपस्थित प्रोटॉन की संख्या होती है। यह किसी तत्व की मौलिक पहचान होती है, और यह आवर्त सारणी में तत्व की स्थिति भी निर्धारित करती है।
परमाणु संख्या ज्ञात करने के तरीके:
- आवर्त सारणी से: प्रत्येक तत्व की परमाणु संख्या आवर्त सारणी में दी जाती है। जैसे हाइड्रोजन (H) की परमाणु संख्या 1, हीलियम (He) की 2 होती है।
- प्रोटॉन गिनकर: यदि किसी परमाणु के नाभिक में मौजूद प्रोटॉनों की संख्या दी गई हो, तो वही उसकी परमाणु संख्या होगी।
- इलेक्ट्रॉनों की संख्या से: यदि परमाणु तटस्थ है (कोई आवेश नहीं है), तो इलेक्ट्रॉनों की संख्या भी प्रोटॉनों के बराबर होती है।
प्रमुख तत्वों की परमाणु संख्या
| तत्व | प्रतीक | परमाणु संख्या |
|---|---|---|
| हाइड्रोजन | H | 1 |
| हीलियम | He | 2 |
| कार्बन | C | 6 |
| नाइट्रोजन | N | 7 |
| ऑक्सीजन | O | 8 |
| सोडियम | Na | 11 |
| मैग्नीशियम | Mg | 12 |
| एल्युमिनियम | Al | 13 |
द्रव्यमान संख्या (Mass Number)
द्रव्यमान संख्या किसी परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या को दर्शाती है। इसे A से दर्शाया जाता है।
यह परमाणु का द्रव्यमान बताने में सहायक होती है, जबकि परमाणु संख्या (Z) केवल प्रोटॉनों की संख्या दर्शाती है।
न्यूट्रॉन की संख्या = द्रव्यमान संख्या – परमाणु संख्या
= 16 – 8 = 8 न्यूट्रॉन
न्यूट्रॉन = 23 – 11 = 12
परमाणु संख्या और द्रव्यमान संख्या
परमाणु संख्या और द्रव्यमान संख्या किसी भी तत्व के परमाणु की संरचना को समझने के लिए अत्यंत आवश्यक अवधारणाएं हैं। आइए इन दोनों को विस्तार से समझें:
यह परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या होती है। यह तत्व की पहचान को दर्शाती है।
यह परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या होती है।
सूत्र:
- परमाणु संख्या (Z) = प्रोटॉनों की संख्या
- द्रव्यमान संख्या (A) = प्रोटॉन + न्यूट्रॉन
- न्यूट्रॉन = द्रव्यमान संख्या – परमाणु संख्या
उदाहरण:
| तत्व | प्रोटॉन | न्यूट्रॉन | परमाणु संख्या (Z) | द्रव्यमान संख्या (A) |
|---|---|---|---|---|
| हाइड्रोजन (H) | 1 | 0 | 1 | 1 |
| हीलियम (He) | 2 | 2 | 2 | 4 |
| कार्बन (C) | 6 | 6 | 6 | 12 |
महत्वपूर्ण प्रश्न:
- किसी तत्व की परमाणु संख्या से हमें कौन-सी जानकारी मिलती है?
- द्रव्यमान संख्या कैसे ज्ञात की जाती है?
- अगर किसी तत्व में 8 प्रोटॉन और 8 न्यूट्रॉन हैं, तो उसका द्रव्यमान संख्या क्या होगी?
परमाणु संख्या और द्रव्यमान संख्या से जुड़े प्रश्नों के उत्तर
प्रश्न 1: यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(a) परमाणु की परमाणुक संख्या क्या है?
(b) परमाणु का क्या आवेश है?
उत्तर:
(a) परमाणु संख्या = प्रोटॉनों की संख्या = 8
(b) चूंकि इलेक्ट्रॉनों की संख्या = प्रोटॉनों की संख्या है, इसलिए परमाणु का कुल आवेश शून्य (0) होगा।
उत्तर: परमाणु द्रव्यमान = प्रोटॉन + न्यूट्रॉन
| तत्व | प्रोटॉनों की संख्या | न्यूट्रॉनों की संख्या | द्रव्यमान संख्या |
|---|---|---|---|
| ऑक्सीजन (O) | 8 | 8 | 16 |
| सल्फर (S) | 16 | 16 | 32 |
नोट: ये द्रव्यमान संख्या सामान्यतः प्राकृतिक समस्थानिकों के आधार पर मानी गई हैं।
समस्थानिक क्या होते हैं?
वह परमाणु जो एक ही रासायनिक तत्व के होते हैं लेकिन उनकी द्रव्यमान संख्या अलग होती है, उन्हें समस्थानिक (Isotopes) कहा जाता है।
• समान परमाणु संख्या, अलग द्रव्यमान संख्या वाले तत्व — स्थानिक।
• रासायनिक गुण समान होते हैं, लेकिन भौतिक गुण अलग हो सकते हैं।
समस्थानिक की विशेषताएँ:
- उनकी परमाणु संख्या समान होती है।
- द्रव्यमान संख्या अलग होती है।
- इलेक्ट्रॉन और प्रोटॉन की संख्या समान होती है, न्यूट्रॉन की संख्या अलग होती है।
उदाहरण:
| तत्व | समस्थानिक | प्रोटॉन | न्यूट्रॉन | द्रव्यमान संख्या |
|---|---|---|---|---|
| हाइड्रोजन | Protium (¹H) | 1 | 0 | 1 |
| हाइड्रोजन | Deuterium (²H) | 1 | 1 | 2 |
| हाइड्रोजन | Tritium (³H) | 1 | 2 | 3 |
| कार्बन | ¹²C और ¹⁴C | 6 | 6 / 8 | 12 / 14 |
समस्थानिक (Isotopes) और संभारिक (Isobars)
समस्थानिक: वे परमाणु होते हैं जिनकी परमाणु संख्या समान होती है लेकिन द्रव्यमान संख्या अलग होती है। इसका अर्थ है कि उनके प्रोटॉन की संख्या समान होती है लेकिन न्यूट्रॉन की संख्या अलग होती है।
हाइड्रोजन के तीन स्थानिक –
- प्रोटियम (¹H) – 1 प्रोटॉन, 0 न्यूट्रॉन
- ड्यूटीरियम (²H) – 1 प्रोटॉन, 1 न्यूट्रॉन
- ट्रिटियम (³H) – 1 प्रोटॉन, 2 न्यूट्रॉन
समस्थानिकों के गुण:
- रासायनिक गुण समान होते हैं क्योंकि उनके इलेक्ट्रॉन समान होते हैं।
- भौतिक गुण अलग होते हैं क्योंकि द्रव्यमान में अंतर होता है।
संभारिक: वे परमाणु होते हैं जिनकी द्रव्यमान संख्या समान होती है लेकिन परमाणु संख्या अलग होती है।
उदाहरण:
- कैल्शियम (²⁰Ca⁴⁰): परमाणु संख्या = 20
- पोटेशियम (¹⁹K⁴⁰): परमाणु संख्या = 19
- आर्गन (¹⁸Ar⁴⁰): परमाणु संख्या = 18
इन सभी का द्रव्यमान संख्या = 40 है।
संभारिकों के गुण:
- द्रव्यमान समान होने के कारण कुछ भौतिक गुण मिलते-जुलते हो सकते हैं।
- रासायनिक गुण अलग-अलग होते हैं क्योंकि परमाणु संख्या (और इलेक्ट्रॉनिक विन्यास) अलग होता है।
संक्षेप में:
- समस्थानिक: Z समान, A अलग
- संभारिक: A समान, Z अलग
अवपरमाणुक कणों की तुलना: H, D और T
| चिह्न | प्रोटॉन | न्यूट्रॉन | इलेक्ट्रॉन |
|---|---|---|---|
| H (प्रोटियम) | 1 | 0 | 1 |
| D (ड्यूटेरियम) | 1 | 1 | 1 |
| T (ट्रिटियम) | 1 | 2 | 1 |
समस्थानिक और समभारिक युग्म का इलेक्ट्रॉनिक विन्यास
समस्थानिक युग्म:
ऑक्सीजन (O):
O16 → इलेक्ट्रॉनिक विन्यास: 2, 6
O18 → इलेक्ट्रॉनिक विन्यास: 2, 6
समभारिक युग्म:
Ca40 और Ar40 → द्रव्यमान संख्या समान है पर परमाणु संख्या भिन्न।
Ca (Z = 20) → इलेक्ट्रॉनिक विन्यास: 2, 8, 8, 2
Ar (Z = 18) → इलेक्ट्रॉनिक विन्यास: 2, 8, 8
आपने क्या सीखा
- इलेक्ट्रॉन और प्रोटॉन की खोज क्रमशः जे. जे. टॉमसन और ई. गोल्डस्टीन ने की।
- जे. जे. टॉमसन ने प्रस्तावित किया कि इलेक्ट्रॉन धनात्मक गोले में धँसे होते हैं।
- रदरफोर्ड के अल्फा कणों के प्रकीर्णन प्रयोग से परमाणु केंद्रक की खोज हुई।
- रदरफोर्ड मॉडल के अनुसार परमाणु के अंदर बहुत छोटा केंद्रक होता है और इलेक्ट्रॉन उसके चारों ओर घूमते हैं, लेकिन यह मॉडल स्थिरता नहीं समझा सका।
- नील बोर के परमाणु मॉडल ने बताया कि इलेक्ट्रॉन निश्चित ऊर्जा कक्षाओं में रहते हैं और जब बाहरी कक्षा भर जाती है, तो परमाणु स्थिर होता है।
- जे. चैडविक ने न्यूट्रॉन की खोज की।
- परमाणु के तीन अवपरमाणुक कण होते हैं: इलेक्ट्रॉन (ऋण आवेशित), प्रोटॉन (धन आवेशित), और न्यूट्रॉन (अनावेशित)।
- इलेक्ट्रॉन का द्रव्यमान हाइड्रोजन परमाणु के द्रव्यमान का लगभग 1/2000 होता है।
- प्रोटॉन और न्यूट्रॉन का द्रव्यमान लगभग 1 इकाई होता है।
- परमाणु के कक्षों को K, L, M, N… नाम दिए गए हैं।
- संयोजकता परमाणु की संयोजन शक्ति को कहते हैं।
- परमाणु संख्या = केंद्रक में प्रोटॉनों की संख्या।
- द्रव्यमान संख्या = न्यूट्रॉन + प्रोटॉन की संख्या (न्यूक्लियॉन)।
- समस्थानिक = एक ही तत्व के वे परमाणु जिनकी द्रव्यमान संख्या अलग होती है।
- समभारिक = वे परमाणु जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या अलग होती है।
- तत्वों को उनके प्रोटॉनों की संख्या के आधार पर परिभाषित किया जाता है।
अभ्यास प्रश्नों के उत्तर — परमाणु की संरचना
1. इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना:
| गुण | इलेक्ट्रॉन | प्रोटॉन | न्यूट्रॉन |
|---|---|---|---|
| आवेश | ऋण (-1) | धन (+1) | शून्य (0) |
| द्रव्यमान | ≈ 1/2000 u | 1 u | 1 u |
| स्थान | परमाणु के बाहरी कक्षों में | परमाणु के केंद्रक में | परमाणु के केंद्रक में |
2. जे. जे. टॉमसन के परमाणु मॉडल की सीमाएँ:
- इस मॉडल ने परमाणु की स्थिरता को नहीं समझाया।
- प्रयोगों से यह सिद्ध नहीं हुआ कि इलेक्ट्रॉन धनात्मक गोले में धँसे होते हैं।
- यह मॉडल रासायनिक गुणों की व्याख्या नहीं कर सका।
3. रदरफोर्ड के परमाणु मॉडल की सीमाएँ:
- इलेक्ट्रॉन परिक्रमा करते हुए ऊर्जा विकीर्ण करता है, जिससे वह अंततः केंद्रक में गिर जाएगा।
- यह मॉडल परमाणु की स्थिरता को नहीं समझा सका।
- यह रासायनिक गुणों की व्याख्या नहीं कर सका।
4. बोर के परमाणु मॉडल की व्याख्या:
- इलेक्ट्रॉन निश्चित ऊर्जा स्तरों (K, L, M…) में केंद्रक के चारों ओर परिक्रमा करते हैं।
- प्रत्येक कक्षा की ऊर्जा स्थिर होती है।
- इलेक्ट्रॉन केवल ऊर्जा का अवशोषण या उत्सर्जन कर उच्च या निम्न कक्षा में जाता है।
- बाहरी कक्ष पूर्ण होने पर परमाणु स्थिर होता है।
5. सभी परमाणु मॉडलों की तुलना:
| मॉडल | विशेषताएँ | सीमाएँ |
|---|---|---|
| जे. जे. टॉमसन | धनात्मक गोला जिसमें ऋणात्मक इलेक्ट्रॉन धँसे होते हैं। | स्थिरता व रासायनिक गुणों की व्याख्या नहीं कर सका। |
| रदरफोर्ड | केंद्रक में प्रोटॉन, इलेक्ट्रॉन उसकी परिक्रमा करते हैं। | इलेक्ट्रॉन ऊर्जा खोकर केंद्रक में गिर जाएगा। |
| बोर | इलेक्ट्रॉन निश्चित ऊर्जा स्तरों में रहते हैं। | केवल हाइड्रोजन जैसे सरल तत्वों के लिए उपयुक्त। |
6. पहले 18 तत्वों के इलेक्ट्रॉन वितरण के नियम:
- प्रत्येक कक्षा में अधिकतम इलेक्ट्रॉन = 2n² (n = कक्षा संख्या)
- K कक्षा: 2, L: 8, M: 18
- पहले 18 तत्वों का इलेक्ट्रॉन वितरण:
| तत्व | परमाणु संख्या | K | L | M |
|---|---|---|---|---|
| हाइड्रोजन | 1 | 1 | – | – |
| हीलियम | 2 | 2 | – | – |
| लिथियम | 3 | 2 | 1 | – |
| बेरिलियम | 4 | 2 | 2 | – |
| बोरॉन | 5 | 2 | 3 | – |
| कार्बन | 6 | 2 | 4 | – |
| नाइट्रोजन | 7 | 2 | 5 | – |
| ऑक्सीजन | 8 | 2 | 6 | – |
| फ्लोरीन | 9 | 2 | 7 | – |
| निऑन | 10 | 2 | 8 | – |
| सोडियम | 11 | 2 | 8 | 1 |
| मैग्नीशियम | 12 | 2 | 8 | 2 |
| एलुमिनियम | 13 | 2 | 8 | 3 |
| सिलिकॉन | 14 | 2 | 8 | 4 |
| फॉस्फोरस | 15 | 2 | 8 | 5 |
| सल्फर | 16 | 2 | 8 | 6 |
| क्लोरीन | 17 | 2 | 8 | 7 |
| आर्गन | 18 | 2 | 8 | 8 |
अभ्यास प्रश्न: परमाणु की संरचना
उत्तर:
संयोजकता किसी तत्व के उस गुण को कहते हैं, जिसके अनुसार वह अन्य तत्वों के साथ रासायनिक बंध बनाता है। यह परमाणु के बाह्यतम कक्षा (valence shell) में उपस्थित इलेक्ट्रॉनों की संख्या पर निर्भर करती है।उदाहरण:
सिलिकॉन (Si) का इलेक्ट्रॉनिक विन्यास = 2, 8, 4 → संयोजकता = 4
ऑक्सीजन (O) का इलेक्ट्रॉनिक विन्यास = 2, 6 → संयोजकता = 2
उत्तर:
परमाणु संख्या (Z): यह किसी परमाणु में उपस्थित प्रोटॉनों की संख्या होती है।
द्रव्यमान संख्या (A): यह परमाणु में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या होती है।
समस्थानिक (Isotopes): वे तत्व जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न हो।
जैसे: H (Protium), D (Deuterium), T (Tritium)
समभारिक (Isobars): वे तत्व जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न हो।
जैसे: Ar-40 (Z=18), Ca-40 (Z=20)दो उपयोग:
1. कार्बन-14 का उपयोग रेडियो डेटिंग में होता है।
2. कोबाल्ट-60 का उपयोग कैंसर उपचार में होता है।
उत्तर: सोडियम परमाणु (Na) का इलेक्ट्रॉनिक विन्यास = 2, 8, 1 होता है। जब यह एक इलेक्ट्रॉन खो देता है, तो Na⁺ आयन बनता है और इसका विन्यास = 2, 8 हो जाता है। अतः इसमें केवल K और L कोश होते हैं और दोनों पूर्ण रूप से भरे होते हैं।
उत्तर:
औसत द्रव्यमान = (79 × 49.7/100) + (81 × 50.3/100)
= 39.263 + 40.743 = 80.006 u (लगभग 80 u)
उत्तर:
माना X-16 का प्रतिशत = x
तो X-17 का प्रतिशत = 100 – x16.2 = (16 × x/100) + (17 × (100 – x)/100)
16.2 = (16x + 1700 – 17x)/100
16.2 = (1700 – x)/100
1620 = 1700 – x
x = 80% (X-16), और X-17 = 20%
प्रश्न 12: यदि तत्व का Z = 3 हो तो तत्व की संयोजकता क्या होगी? तत्व का नाम भी लिखिए।
लिथियम का इलेक्ट्रॉन विन्यास: 2, 1
इसके बाह्य कक्षा में 1 इलेक्ट्रॉन होता है, अतः यह उसे खोकर स्थिरता प्राप्त करता है।
इसलिए, लिथियम की संयोजकता = 1 होती है।
प्रश्न 13: दो परमाणु स्पीशीज के केंद्रकों का संघटन नीचे दिया गया है
| तत्व | प्रोटॉन | न्यूट्रॉन | द्रव्यमान संख्या |
|---|---|---|---|
| X | 6 | 6 | 12 |
| Y | 6 | 8 | 14 |
इसलिए ये समस्थानिक (Isotopes) हैं क्योंकि उनके परमाणु क्रमांक समान हैं लेकिन द्रव्यमान संख्या अलग है।
प्रश्न 14: निम्नलिखित वक्तव्यों में गलत के लिए और सही के लिए T लिखें।
| वक्तव्य | T / F |
|---|---|
| (a) जे. जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केंद्रक में केवल न्यूक्लीयॉन्स होते हैं। | F |
| (b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं इसलिए यह अनावेशित होता है। | F |
| (c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग 2000 गुणा कम होता है। | T |
| (d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है। | T |
रदरफोर्ड का प्रयोग, समस्थानिक, Cl⁻ आयन, और सोडियम का इलेक्ट्रॉनिक विन्यास – प्रश्नोत्तर
प्रश्न 15: रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था?
(a) परमाणु केंद्रक
(b) इलेक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन
उत्तर: (a) परमाणु केंद्रक
व्याख्या: रदरफोर्ड के प्रयोग ने परमाणु के केंद्र में स्थित नाभिक की खोज में सहायता की।
प्रश्न 16: एक तत्व के समस्थानिक में होते हैं:
(a) समान भौतिक गुण
(b) भिन्न रासायनिक गुण
(c) न्यूट्रॉनों की अलग-अलग संख्या
(d) भिन्न परमाणु संख्या
उत्तर: (c) न्यूट्रॉनों की अलग-अलग संख्या
व्याख्या: समस्थानिकों में प्रोटॉन की संख्या समान लेकिन न्यूट्रॉन की संख्या अलग होती है।
प्रश्न 17: Cl⁻ आयन में संयोजकता इलेक्ट्रॉनों की संख्या है:
(a) 16
(b) 8
(c) 17
(d) 18
उत्तर: (d) 18
व्याख्या: क्लोरीन में 17 इलेक्ट्रॉन होते हैं। Cl⁻ आयन बनने पर 1 इलेक्ट्रॉन और जुड़ता है, कुल = 18 इलेक्ट्रॉन।
प्रश्न 18: सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन सा है?
(a) 2,8
(b) 8.2.1
(c) 2.1.8
(d) 2.8.1
उत्तर: (d) 2.8.1
व्याख्या: सोडियम की परमाणु संख्या 11 है। इसका विन्यास 2,8,1 होता है।
परमाणु की सारणी
| परमाणु संख्या | द्रव्यमान संख्या | न्यूट्रॉनों की संख्या | प्रोटॉनों की संख्या | इलेक्ट्रॉनों की संख्या | परमाणु स्पीशीज |
|---|---|---|---|---|---|
| 9 | 19 | 10 | 9 | 9 | F (Fluorine) |
| 16 | 32 | 16 | 16 | 16 | सल्फर |
| 12 | 24 | 12 | 12 | 12 | Mg (Magnesium) |
| 1 | 2 | 1 | 1 | 1 | H (Hydrogen-2) |
| 1 | 1 | 0 | 1 | 0 | H+ (Hydrogen ion) |
कक्षा 9 विज्ञान – अध्याय 4: परमाणु की संरचना – बहुविकल्पीय प्रश्न (MCQs)
नीचे दिए गए प्रश्न NCERT पाठ्यक्रम पर आधारित हैं और परीक्षा की दृष्टि से अत्यंत महत्वपूर्ण हैं।
A) इलेक्ट्रॉन में
B) न्यूट्रॉन में
C) प्रोटॉन में
D) नाभिक में
उत्तर: D) नाभिक में
A) गोल्डस्टीन
B) रदरफोर्ड
C) जे जे थॉमसन
D) नील्स बोर
उत्तर: C) जे जे थॉमसन
A) चैडविक
B) रदरफोर्ड
C) गोल्डस्टीन
D) बोहर
उत्तर: C) गोल्डस्टीन
A) 1 C
B) 1.6 × 10⁻¹⁹ C
C) 1.6 × 10¹⁹ C
D) 0.6 C
उत्तर: B) 1.6 × 10⁻¹⁹ C
A) प्रोटॉन
B) न्यूट्रॉन
C) इलेक्ट्रॉन
D) उपरोक्त सभी
उत्तर: C) इलेक्ट्रॉन
A) समान द्रव्यमान संख्या वाले
B) समान परमाणु संख्या वाले
C) समान इलेक्ट्रॉन संख्या वाले
D) अलग इलेक्ट्रॉनिक विन्यास वाले
उत्तर: B) समान परमाणु संख्या वाले
A) कक्षा
B) कक्ष
C) पथ
D) आवृत्ति
उत्तर: A) कक्षा
A) अणु के चारों ओर
B) न्यूट्रॉन के चारों ओर
C) नाभिक के निश्चित कक्षों में
D) प्रोटॉन के चारों ओर
उत्तर: C) नाभिक के निश्चित कक्षों में
A) प्रोटॉन से अधिक
B) न्यूट्रॉन के बराबर
C) बहुत ही कम
D) शून्य
उत्तर: C) बहुत ही कम
A) प्रोटॉन + इलेक्ट्रॉन
B) प्रोटॉन + न्यूट्रॉन
C) न्यूट्रॉन + इलेक्ट्रॉन
D) प्रोटॉन – इलेक्ट्रॉन
उत्तर: B) प्रोटॉन + न्यूट्रॉन
A) धनात्मक
B) ऋणात्मक
C) शून्य
D) दोनों
उत्तर: C) शून्य
A) समान द्रव्यमान संख्या वाले
B) समान परमाणु संख्या वाले
C) अलग परमाणु संख्या वाले
D) अलग द्रव्यमान संख्या वाले
उत्तर: A) समान द्रव्यमान संख्या वाले
A) इलेक्ट्रॉन में
B) नाभिक में
C) इलेक्ट्रॉन कक्षा में
D) पूरे परमाणु में समान
उत्तर: B) नाभिक में
A) 1
B) 2
C) 8
D) 3
उत्तर: A) 1
A) प्रोटॉन की संख्या में
B) इलेक्ट्रॉन की संख्या में
C) न्यूट्रॉन की संख्या में
D) परमाणु संख्या में
उत्तर: C) न्यूट्रॉन की संख्या में
A) रदरफोर्ड
B) चैडविक
C) थॉमसन
D) बोहर
उत्तर: B) चैडविक
A) केवल प्रोटॉन
B) केवल न्यूट्रॉन
C) प्रोटॉन व न्यूट्रॉन दोनों
D) केवल इलेक्ट्रॉन
उत्तर: C) प्रोटॉन व न्यूट्रॉन दोनों
A) प्रोटॉन
B) न्यूट्रॉन
C) इलेक्ट्रॉन
D) नाभिक
उत्तर: C) इलेक्ट्रॉन
A) इलेक्ट्रॉन में
B) प्रोटॉन में
C) न्यूट्रॉन में
D) कोई अंतर नहीं
उत्तर: C) न्यूट्रॉन में
A) 6
B) 12
C) 0
D) 3
उत्तर: B) 12
कक्षा 9 विज्ञान – अध्यायवार सूची (2025-26)
- हमारे आस-पास के पदार्थ
- क्या हमारे आस-पास के पदार्थ शुद्ध हैं?
- परमाणु एवं अणु
- परमाणु की संरचना
- जीवन की मौलिक इकाई
- ऊतक
- गति
- बल तथा गति के नियम
- गुरुत्वाकर्षण
- कार्य तथा ऊर्जा
- ध्वनि
- खाद्य संसाधनों में सुधार
External Links – परमाणु की संरचना
- NCERT आधिकारिक पाठ्यपुस्तक (PDF) – अध्याय 4
– एनसीईआरटी की आधिकारिक वेबसाइट से अध्याय डाउनलोड करें। - Physics Wallah: परमाणु की संरचना (वीडियो)
– सरल भाषा में वीडियो व्याख्या। - BYJU’S NCERT समाधान – अध्याय 4 (हिंदी)
– सारांश और अभ्यास प्रश्न उत्तर। - Khan Academy – Structure of Atom (English)
– फ्री इंटरैक्टिव वीडियो व अभ्यास (अंग्रेज़ी)। - Vedantu – अध्याय 4 NCERT समाधान
– विस्तार से हल व स्पष्टीकरण।