विद्युत धारा के रासायनिक प्रभाव
जब किसी विद्युत् परिपथ में धारा प्रवाहित होती है तो उसके द्वारा कई रासायनिक परिवर्तन होते हैं — इसे विद्युत धारा के रासायनिक प्रभाव कहते हैं। इस अध्याय में हम इलेक्ट्रोलिसिस, इलेक्ट्रोड, इलेक्ट्रोलाइट और इनके उपयोगों के बारे में सरल भाषा में जानेंगे।
मुख्य बिंदु:
- इलेक्ट्रोलिसिस की प्रक्रिया।
- इलेक्ट्रोड, इलेक्ट्रोलाइट और आयन।
- धातु चढ़ाना (Electroplating)।
- विज्ञान और उद्योग में उपयोग।
महत्वपूर्ण तथ्य:
इलेक्ट्रोलिसिस में धनात्मक आयन कैथोड की ओर और ऋणात्मक आयन ऐनोड की ओर जाकर रासायनिक परिवर्तन कराते हैं।
उदाहरण:
- धातुओं पर परत चढ़ाना (इलेक्ट्रोप्लेटिंग)।
- पानी का विद्युत विघटन।
- धातु शुद्धिकरण।
क्या द्रव विद्युत चालन करते हैं?
सभी द्रव विद्युत का चालन नहीं करते। केवल वे द्रव जिनमें आयन मौजूद हों,
विद्युत का चालन करते हैं। ऐसे द्रवों को इलेक्ट्रोलाइट कहा जाता है।
महत्वपूर्ण तथ्य:
आयन वाले द्रव = विद्युत चालक
आयन रहित द्रव = गैर-चालक
विद्युत चालक द्रव
- नमक का घोल
- अम्ल
- क्षार
- नल का पानी
गैर-चालक द्रव
- शुद्ध पानी (डिस्टिल्ड water)
- चीनी का घोल
- तेल
- पेट्रोल / केरोसीन
एक संपरीक्षित्र का प्रयोग और निष्कर्ष
किसी द्रव के विद्युत चालन की जांच करने के लिए हम एक सरल संपरीक्षित्र (Tester) का उपयोग करते हैं।
इसमें एक बैटरी, दो तार, एक बल्ब या LED और दो इलेक्ट्रोड होते हैं।
प्रयोग
- संपरीक्षित्र के दोनों इलेक्ट्रोडों को जांचे जाने वाले द्रव में डुबोएं।
- ध्यान रखें कि इलेक्ट्रोड एक-दूसरे को न छूएं।
- बैटरी से बल्ब को जोड़कर परिपथ पूरा करें।
- यदि द्रव विद्युत का चालन करेगा, तो बल्ब हल्का या तेज जल उठेगा।
निष्कर्ष
- यदि बल्ब जलता है → द्रव विद्युत चालक है।
- यदि बल्ब नहीं जलता → द्रव गैर-चालक है।
- कुछ द्रवों में बल्ब कम रोशनी देता है, इसका मतलब चालन कम है।
इस प्रयोग से हम यह भी समझते हैं कि द्रव में मौजूद आयन ही विद्युत चालन करवाते हैं।
सुचालक/हीन चालक द्रव
| क्रम संख्या | पदार्थ | चुंबकीय सुई विचलन दर्शाती है (हाँ/नहीं) | सुचालक/हीन चालक |
|---|---|---|---|
| 1 | नींबू का रस | हाँ | अच्छा चालक |
| 2 | सिरका | हाँ | अच्छा चालक |
| 3 | टोंटी का पानी | हाँ | कमजोर चालक |
| 4 | वनस्पति तेल | नहीं | हीन चालक |
| 5 | दूध | हाँ (हल्का) | कमजोर चालक |
| 6 | शहद | नहीं | हीन चालक |
| 7 | डिस्टिल्ड पानी | नहीं | हीन चालक |
| 8 | नमक का घोल | हाँ | अच्छा चालक |
| 9 | चीनी का घोल | नहीं | हीन चालक |
| 10 | साबुन का पानी | हाँ | अच्छा चालक |
| 11 | नींबू पानी | हाँ | अच्छा चालक |
| 12 | गर्म पानी | हाँ (ज़्यादा आयन) | कमजोर चालक |
विद्युत धारा का रासायनिक प्रभाव
जब किसी द्रव में विद्युत धारा प्रवाहित की जाती है, तो उस द्रव में कुछ रासायनिक परिवर्तन होते हैं।
इन्हें ही विद्युत धारा के रासायनिक प्रभाव कहा जाता है।
1. द्रव का अपघटन (Electrolysis)
विद्युत धारा के कारण द्रव अपने घटकों में टूट जाता है। जैसे नमक का घोल आयनों में टूट जाता है।
2. धातु की परत का जमना (Electroplating)
इलेक्ट्रोड पर किसी धातु की पतली परत जम जाती है, जैसे चम्मच पर चांदी या सोने की परत चढ़ाना।
3. गैस का निकलना
कुछ द्रवों में धारा देने पर इलेक्ट्रोड पर गैस बनने लगती है। जैसे पानी में हाइड्रोजन और ऑक्सीजन निकलते हैं।
4. रंग में परिवर्तन
कुछ द्रवों या इलेक्ट्रोड का रंग बदल सकता है। यह आयनों के स्थानांतरण से होता है।
निष्कर्ष:
विद्युत धारा द्रवों में कई तरह के रासायनिक परिवर्तन लाती है जैसे अपघटन होना, गैस बनना, धातु की परत जमना आदि।
क्रियाकलाप – विद्युत धारा के रासायनिक प्रभाव
इस क्रियाकलाप में हम जानेंगे कि द्रव में विद्युत धारा प्रवाहित करने पर क्या-क्या परिवर्तन होते हैं।
इसके लिए एक सरल परिपथ और एक द्रव का उपयोग किया जाता है।
आवश्यक सामग्री
- बैटरी
- दो तार
- LED या बल्ब
- दो इलेक्ट्रोड (कार्बन या धातु की पट्टियाँ)
- नमक का घोल या नींबू का रस
प्रक्रिया
- बैटरी, LED और तारों की सहायता से एक सरल परिपथ बनाएं।
- दोनों इलेक्ट्रोडों को द्रव से भरी पेट्री डिश या कटोरी में डुबोएं।
- ध्यान रखें कि इलेक्ट्रोड आपस में न छूएं।
- परिपथ को पूरा करके देखें कि LED जलती है या नहीं।
- कुछ समय बाद इलेक्ट्रोड के पास होने वाले परिवर्तनों को ध्यान से देखें।
परिणाम (जो दिखाई देंगे)
- LED जलती है → द्रव विद्युत का चालक है।
- इलेक्ट्रोड पर बुलबुले दिखाई देते हैं → गैस निकल रही है।
- इलेक्ट्रोड पर किसी धातु का जमाव दिख सकता है।
- कुछ द्रवों का रंग हल्का बदल सकता है।
निष्कर्ष
इस क्रियाकलाप से पता चलता है कि विद्युत धारा द्रवों में रासायनिक परिवर्तन करती है, जैसे गैस निकलना,
धातु का जमना, या द्रव का अपघटन होना।
विलियम निकलसन का प्रयोग
विलियम निकलसन ने यह पता लगाने के लिए एक महत्वपूर्ण प्रयोग किया कि
क्या विद्युत धारा पानी में प्रवाहित करने पर किसी प्रकार का परिवर्तन होता है या नहीं।
इस प्रयोग ने विद्युत अपघटन (Electrolysis) की समझ को जन्म दिया।
प्रयोग की विधि
1. पानी से भरे एक पात्र में थोड़ी मात्रा में किसी अम्ल या नमक को मिलाया गया ताकि पानी विद्युत चालक बन जाए।
2. दो इलेक्ट्रोड (धातु की छड़ें) पानी में डाली गईं।
3. इन इलेक्ट्रोडों को बैटरी से जोड़ा गया।
4. बैटरी चालू करते ही इलेक्ट्रोडों पर बुलबुले बनते दिखाई देने लगे।
प्रयोग से प्राप्त निष्कर्ष
पानी विद्युत धारा के प्रभाव से टूटकर गैसों में बदल जाता है (अपघटन)।
धनात्मक इलेक्ट्रोड (एनोड) पर ऑक्सीजन गैस बनी।
ऋणात्मक इलेक्ट्रोड (कैथोड) पर हाइड्रोजन गैस बनी।
इससे सिद्ध हुआ कि विद्युत धारा रासायनिक परिवर्तन करा सकती है।
महत्व :-
यह प्रयोग विद्युत अपघटन के सिद्धांत को स्थापित करने वाला पहला सफल प्रयोग था,
जिससे बाद में इलेक्ट्रोप्लेटिंग, शुद्धिकरण और अनेक रासायनिक उद्योग विकसित हुए।
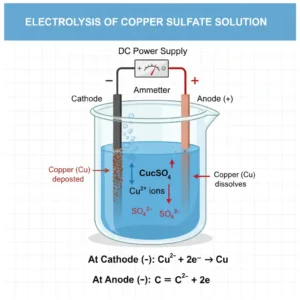
विद्युतलेपन (Electroplating)
विद्युत लेपन वह प्रक्रिया है जिसमें किसी धातु की सतह पर दूसरी धातु की एक पतली परत
जमाई जाती है। यह प्रक्रिया विद्युत धारा पास करके की जाती है। इससे वस्तु की चमक,
मजबूती और जंग-रोधी क्षमता बढ़ जाती है।
कॉपर सल्फेट, सिल्वर नाइट्रेट, निकेल सल्फेट जैसे इलेक्ट्रोलाइट घोल उपयोग किए जाते हैं।
विद्युतलेपन कैसे किया जाता है?
विद्युत लेपन की प्रक्रिया निम्न प्रकार से होती है:
- जिस वस्तु पर लेपन करना है, उसे कैथोड (-) से जोड़ा जाता है।
- जिस धातु की कोटिंग करनी है, उसे ऐनोड (+) से जोड़ा जाता है।
- दोनों को इलेक्ट्रोलाइट वाले घोल में डुबो दिया जाता है।
- घोल में विद्युत धारा प्रवाहित करने पर ऐनोड की धातु के कण कैथोड पर जम जाते हैं।
विद्युतलेपन के उपयोग
- चांदी या सोने की परत चम्मच, आभूषण आदि पर चढ़ाना
- लोहे पर जंग रोकने के लिए जिंक/क्रोमियम की परत चढ़ाना
- गाड़ियों के पार्ट्स पर निकेल की चमकीली परत चढ़ाना
महत्वपूर्ण परिभाषाएँ (Important Definitions)
| शब्द | परिभाषा |
|---|---|
| इलेक्ट्रोलाइट | ऐसे द्रव जो विद्युत प्रवाहित होने पर आयनों में टूट जाते हैं और विद्युत का संचालन करते हैं। |
| इलेक्ट्रोड | धातु की छड़ या प्लेट जिसे इलेक्ट्रोलाइट में डुबोकर धारा प्रवाहित की जाती है। |
| ऐनोड | धारा का धनात्मक ( + ) सिरा जिससे धातु के कण घोल में निकलते हैं। |
| कैथोड | धारा का ऋणात्मक ( – ) सिरा जिस पर धातु के कण जमा होते हैं। |
| इलेक्ट्रोप्लेटिंग (विद्युत लेपन) | धातु की सतह पर दूसरी धातु की पतली परत विद्युत धारा द्वारा चढ़ाने की प्रक्रिया। |
| रासायनिक प्रभाव | जब विद्युत धारा किसी द्रव से गुजरकर उसमें रासायनिक परिवर्तन करती है, उसे रासायनिक प्रभाव कहते हैं। |
| अपघटन (Electrolysis) | विद्युत धारा द्वारा इलेक्ट्रोलाइट का आयनों में टूटना और विभाजन होना। |
सम्पूर्ण हल प्रश्नोत्तर:-
(a) विद्युत चालक करते वाले अधिपदार्थ द्रव ________ तथा ________ के विलयन होते हैं।
(b) किसी विलयन में विद्युत धारा प्रवाहित होने पर ________ प्रभाव उत्पन्न होता है।
(c) यदि कॉपर इलेक्ट्रोड विलयन से विद्युत धारा प्रवाहित की जाए तो कॉपर बैटरी के ________ टर्मिनल से संयोजित सेट पर निर्लिप्त होता है।
(d) विद्युत धारा द्वारा किसी पदार्थ पर वांछित धातु को परत चढ़ाने की प्रक्रिया को ________ कहते हैं।
(a) पिघले हुए लवण तथा जलीय विलयन
(b) रासायनिक
(c) धन (या एनोड)
(d) विद्युत लेपन (Electroplating)
2. जब किसी संधारित्र के प्लेटों सिरों को किसी विद्युत स्रोत से जोड़ने के तुरंत बाद विलयन होता है। क्या आप समझते हैं कि धारा की व्याख्या कर सकते हैं?
हाँ, समझा जा सकता है। जब संधारित्र को बैटरी से जोड़ा जाता है, तो:
- बैटरी के धन सिरे से इलेक्ट्रॉन प्लेट A की ओर जाते हैं → प्लेट A पर ऋण आवेश संचित होता है।
- प्लेट B से इलेक्ट्रॉन बैटरी के ऋण सिरे की ओर जाते हैं → प्लेट B पर धन आवेश संचित होता है।
- इस प्रक्रिया में चार्जिंग करंट प्रवाहित होता है।
- जब दोनों प्लेटों पर आवेश संतुलित हो जाता है, तो करंट शून्य हो जाता है।
उत्तर:
- शुद्ध जल (Distilled Water) – ρ ≈ 1.8 × 10⁶ Ω·m
- ग्लिसरीन – ρ ≈ 1.0 × 10⁶ से 1.5 × 10⁶ Ω·m
- क्वार्ट्ज (Quartz) – ρ ≈ 10¹² Ω·m (अधिक, पर उदाहरण के लिए)
नोट: वास्तव में 1 से 1.9 मेगओहम प्रतिरोधकता वाले ठोस/द्रव दुर्लभ हैं। आमतः सेमीकंडक्टर जैसे जर्मेनियम, सिलिकॉन (डोपिंग पर निर्भर) इस श्रेणी में आ सकते हैं।
4. चित्र 11.10 में दर्शायी गई व्यवस्था में बल्ब नहीं जलता। क्या आप सम्भावित कारणों की सूची बना सकते हैं? अपने उत्तर की व्याख्या कीजिए।
संभावित कारण:
- बल्ब खराब है (फिलामेंट टूटा हुआ)।
- बैटरी डिस्चार्ज (वोल्टेज शून्य या बहुत कम)।
- तार टूटा हुआ या कनेक्शन ढीला।
- स्विच बंद है (यदि सर्किट में स्विच हो)।
- विलयन में कोई चालकता नहीं (यदि विलयन है, जैसे शुद्ध जल)।
- इलेक्ट्रोड जंग लगे या ऑक्साइड परत → प्रतिरोध बहुत अधिक।
(i) द्रव A, द्रव B से अच्छा चालक है।
(ii) द्रव B, द्रव A से अच्छा चालक है।
(iii) दोनों द्रवों की चालकता समान है।
(iv) द्रवों की चालकता के गुणों की तुलना इस प्रकार नहीं की जा सकती।
विश्लेषण:
संधारित्र में चार्जिंग करंट आयनों की गतिशीलता पर निर्भर करता है। यदि द्रव A में अधिक करंट → अधिक आयन → अधिक चालकता।
नहीं, शुद्ध जल विद्युत का चालक नहीं करता क्योंकि इसमें आयन नहीं होते।
चालक बनाने के लिए:
→ इसमें नमक (NaCl), एसिड (HCl), या क्षार (NaOH) घोलें → आयन उत्पन्न होंगे → चालकता बढ़ेगी।
पानी (विशेषकर नल का पानी) में अशुद्धियाँ होती हैं → यह चालक बन जाता है। यदि विद्युत आपूर्ति चालू रही तो पानी के माध्यम से करंट प्रवाहित होकर फायरमैन को झटका लग सकता है। इसलिए सुरक्षा के लिए मुख्य स्विच बंद किया जाता है।
समुद्र का पानी में नमक (NaCl) की मात्रा अधिक होती है → अधिक आयन (Na⁺, Cl⁻) → अधिक चालकता → अधिक करंट → गैल्वेनोमीटर में अधिक विक्षेप।
कारण:
→ पतंग की डोर गीली हो जाती है → चालक बन जाती है।
→ यदि बिजली गिरे तो करंट डोर के माध्यम से व्यक्ति तक पहुँच सकता है → मृत्यु तक हो सकती है।
कारण:
→ पाइप प्लास्टिक या इंसुलेटेड होती हैं।
→ पम्प मोटर ग्राउंडेड होती है।
→ कोई लीकेज होने पर भी करंट पृथ्वी में चला जाता है, व्यक्ति को झटका नहीं लगता।
उदाहरण:
- लोहे की कील
- ग्रेफाइट (पेंसिल की नोक)
- मानव शरीर (पसीने के कारण)
- नमकीन पानी
- ताँबा, एल्यूमिनियम के तार
धन टर्मिनल (एनोड): वह इलेक्ट्रोड जहाँ ऑक्सीकरण होता है → धातु का क्षय → पतली सुई (क्योंकि कम धातु, अधिक क्षय)।
ऋण टर्मिनल (कैथोड): जहाँ अवक्षेपण होता है → मोटा तार।
विद्युत धारा के रासायनिक प्रभाव
कक्षा 8 विज्ञान | 30 बहुविकल्पीय प्रश्न (MCQ) | NCERT आधारित
1. विद्युत धारा के रासायनिक प्रभाव का सबसे अच्छा उदाहरण क्या है?
A) बल्ब का जलना
B) पंखे का घूमना
C) विलयन में गैसें निकलना
D) चुम्बक बनना
उत्तर: C — जब विद्युत धारा विलयन से होकर गुजरती है तो गैसें (H₂, O₂) निकलती हैं।
2. विद्युत अपघटन में प्रयुक्त होने वाले पदार्थ को क्या कहते हैं?
A) चालक
B) विद्युत अपघट्य
C) संधारित्र
D) प्रतिरोधक
उत्तर: B — जैसे CuSO₄ विलयन।
3. विद्युत अपघटन में धनात्मक आयन किस इलेक्ट्रोड की ओर जाते हैं?
A) कैथोड (ऋण)
B) एनोड (धन)
C) बैटरी
D) तार
उत्तर: A — धनात्मक आयन ऋण इलेक्ट्रोड की ओर।
4. विद्युत लेपन का मुख्य उद्देश्य क्या है?
A) धातु को पिघलाना
B) जंग से बचाना
C) धातु को चमकाना
D) धातु को तोड़ना
उत्तर: B — लोहे पर क्रोमियम चढ़ाकर जंग रोधी बनाते हैं।
5. निम्न में से कौन सा पदार्थ विद्युत अपघट्य है?
A) शुद्ध जल
B) नमक का पानी
C) प्लास्टिक
D) कांच
उत्तर: B — नमक के पानी में आयन होते हैं।
6. विद्युत अपघटन के दौरान कैथोड पर क्या होता है?
A) धातु का निक्षेपण
B) गैस निकलना
C) धातु का घुलना
D) कुछ नहीं
उत्तर: A — धातु जमा होती है।
7. शुद्ध जल विद्युत का चालक क्यों नहीं है?
A) यह ठोस है
B) इसमें आयन नहीं होते
C) यह बहुत गर्म है
D) यह चिपचिपा है
उत्तर: B — आयन न होने से धारा नहीं चलती।
8. विद्युत लेपन में कौन सा इलेक्ट्रोड धातु की परत चढ़ाने के लिए होता है?
A) कैथोड
B) एनोड
C) बैटरी
D) स्विच
उत्तर: A — जिस वस्तु पर परत चढ़ानी हो, उसे कैथोड बनाते हैं।
9. निम्न में से कौन सा विद्युत अपघट्य नहीं है?
A) नींबू का रस
B) नमक का पानी
C) शुष्क लकड़ी
D) सिरका
उत्तर: C — शुष्क लकड़ी में आयन नहीं होते।
10. विद्युत अपघटन में एनोड पर क्या निकलता है?
A) हाइड्रोजन
B) ऑक्सीजन
C) ताँबा
D) सोना
उत्तर: B — जल के अपघटन में ऑक्सीजन निकलती है।
11. विद्युत लेपन में प्रयुक्त होने वाली धातु कौन सी होती है?
A) लकड़ी
B) निकल, क्रोमियम
C) कागज
D) प्लास्टिक
उत्तर: B — निकल, क्रोमियम, सोना आदि।
12. LED का पूरा नाम क्या है?
A) Light Emitting Diode
B) Low Energy Device
C) Light Electric Device
D) Long Energy Diode
उत्तर: A
13. निम्न में से कौन विद्युत अपघट्य है?
A) सिरका
B) शराब
C) शुद्ध तेल
D) रबड़
उत्तर: A — सिरका में आयन होते हैं।
14. विद्युत अपघटन में कौन सी गैस कैथोड पर निकलती है?
A) हाइड्रोजन
B) ऑक्सीजन
C) नाइट्रोजन
D) कार्बन डाइऑक्साइड
उत्तर: A
15. विद्युत लेपन में एनोड किस धातु का बना होता है?
A) चढ़ाई जाने वाली धातु
B) लोहा
C) प्लास्टिक
D) कांच
उत्तर: A — जैसे सोने का लेपन → सोने का एनोड।
16. निम्न में से कौन सा अच्छा चालक है?
A) शुष्क कागज
B) प्लास्टिक
C) नमकीन पानी
D) रबड़
उत्तर: C
17. विद्युत धारा के रासायनिक प्रभाव का उपयोग कहाँ होता है?
A) पंखा चलाने में
B) धातु शोधन में
C) टीवी चलाने में
D) रेडियो में
उत्तर: B
18. विद्युत अपघट्य में धारा किसके द्वारा चलती है?
A) इलेक्ट्रॉन
B) आयन
C) प्रोटॉन
D) न्यूट्रॉन
उत्तर: B
19. विद्युत लेपन में वस्तु को किस इलेक्ट्रोड से जोड़ा जाता है?
A) कैथोड
B) एनोड
C) बैटरी के बीच
D) स्विच
उत्तर: A
20. शुद्ध जल में नमक डालने पर क्या होता है?
A) यह ठोस हो जाता है
B) यह चालक बन जाता है
C) यह गर्म हो जाता है
D) कुछ नहीं
उत्तर: B
21. विद्युत अपघटन में कौन सी धातु कैथोड पर जमा होती है?
A) ताँबा
B) ऑक्सीजन
C) हाइड्रोजन
D) क्लोरीन
उत्तर: A — CuSO₄ में ताँबा।
22. विद्युत लेपन किसे रोकता है?
A) चमक
B) जंग
C) गर्मी
D) आवाज
उत्तर: B
23. निम्न में से कौन विद्युत का कुचालक है?
A) नमक का पानी
B) नींबू का रस
C) शुष्क कपड़ा
D) लोहा
उत्तर: C
24. विद्युत अपघटन में एनोड पर क्या होता है?
A) धातु जमा होती है
B) धातु घुलती है
C) कुछ नहीं
D) गर्मी निकलती है
उत्तर: B
25. विद्युत धारा के तीन प्रभाव कौन से हैं?
A) प्रकाश, ध्वनि, गति
B) ताप, चुंबकीय, रासायनिक
C) रंग, स्वाद, गंध
D) ठंडक, हवा, पानी
उत्तर: B
26. विद्युत लेपन में विलयन क्या होता है?
A) शुद्ध जल
B) धातु का लवण विलयन
C) तेल
D) शराब
उत्तर: B
27. नींबू का रस विद्युत का चालक है क्योंकि?
A) यह मीठा है
B) इसमें अम्ल है
C) यह ठंडा है
D) यह पीला है
उत्तर: B
28. विद्युत अपघटन में बैटरी का धन सिरा किससे जुड़ा होता है?
A) कैथोड
B) एनोड
C) बीच में
D) स्विच
उत्तर: B
29. विद्युत लेपन का उपयोग कहाँ नहीं होता?
A) गहने बनाने में
B) साइकिल के हैंडल पर
C) कागज की किताब पर
D) कार के पार्ट्स पर
उत्तर: C
30. विद्युत धारा के रासायनिक प्रभाव का उपयोग किसमें नहीं होता?
A) बैटरी बनाना
B) धातु शोधन
C) पंखा चलाना
D) विद्युत लेपन
उत्तर: C — पंखा चुंबकीय प्रभाव से चलता है।
विद्युत धारा के रासायनिक प्रभाव के बारे और पढ़ें –
Related Links on InspireVeda