Chapter 9 – Biomolecules (जैव अणु)
जब हम जीवन (Life) की बात करते हैं तो हमें यह समझना जरूरी है कि
हर जीवित प्राणी का शरीर अणुओं (Molecules) से बना है।
यही molecules, जब life-related functions को perform करते हैं,
तो उन्हें हम Biomolecules कहते हैं।
जैसे कि अगर आप किसी पौधे या जानवर की कोशिका (Cell) का analysis करेंगे तो उसमें
Water, Minerals, Carbohydrates, Proteins, Lipids और Nucleic acids पाए जाएँगे।
यही molecules मिलकर cellular structure और metabolic activities को नियंत्रित करते हैं।
Importance of Biomolecules (महत्त्व)
- Carbohydrates (कार्बोहाइड्रेट): Energy providers, जैसे Glucose।
- Proteins (प्रोटीन): Structural और functional molecules, enzymes और hormones के रूप में।
- Lipids (वसा): Energy storage, membrane structure और signaling molecules।
- Nucleic acids (DNA & RNA): Genetic information का carrier।
- Vitamins & Minerals: Enzyme activation और metabolic balance के लिए।
Biomolecules को समझने से हमें यह पता चलता है कि Life processes (जीवन क्रियाएँ) कैसे चलती हैं –
respiration, photosynthesis, protein synthesis और cell division सब biomolecules की वजह से possible है।
– Term “Biomolecule” का अर्थ है – कोई भी ऐसा organic molecule जो जीवित प्राणियों में पाया जाए।
– हमारे शरीर का लगभग 70–80% भाग पानी है और बाकी हिस्सा biomolecules का।
– Without biomolecules, life is impossible!
Topics Covered in This Chapter
- Carbohydrates – Classification and Functions
- Proteins – Structure (Primary to Quaternary) and Functions
- Lipids – Types and Biological Role
- Nucleic Acids – DNA & RNA, Structure and Functions
- Enzymes – Nature, Properties and Mechanism of Action
इस chapter को detail में पढ़ने से आप समझ पाओगे कि
life के molecular secrets कैसे काम करते हैं और
कैसे simple molecules मिलकर complex living systems का निर्माण करते हैं।
Elements Present in Non-Living and Living Matter
All matter, whether living or non-living, is composed of chemical elements. However, the type and proportion of elements differ in both. The following table provides a comparison of major elements found in living organisms and non-living matter.
| Category | Major Elements Present | Percentage (Approx.) |
|---|---|---|
| Non-Living Matter (Earth’s Crust) | Oxygen (O), Silicon (Si), Aluminium (Al), Iron (Fe), Calcium (Ca), Sodium (Na), Potassium (K), Magnesium (Mg) | O: 46.6%, Si: 27.7%, Al: 8.1%, Fe: 5.0%, Ca: 3.6%, Na: 2.8%, K: 2.6%, Mg: 2.1% |
| Living Matter (Human Body) | Oxygen (O), Carbon (C), Hydrogen (H), Nitrogen (N), Calcium (Ca), Phosphorus (P), Potassium (K), Sulphur (S), Sodium (Na), Chlorine (Cl), Magnesium (Mg), Iron (Fe), Iodine (I) | O: 65%, C: 18.5%, H: 9.5%, N: 3.3%, Ca: 1.5%, P: 1.0%, K: 0.4%, S: 0.3%, Na: 0.2%, Cl: 0.2%, Mg: 0.1% |
Key Point
Non-living matter is dominated by Silicon and Aluminium along with Oxygen, while living organisms are primarily made up of Carbon, Hydrogen, Oxygen, and Nitrogen (CHON), which account for more than 95% of the body’s weight.
How to Analyse Chemical Composition (रासायनिक संरचना का विश्लेषण)
Living organisms (जीवित प्राणी) और non-living matter (निर्जीव पदार्थ) दोनों में chemical elements और biomolecules पाए जाते हैं।
इनकी study करने के लिए scientists दो main तरीके use करते हैं: Elemental Analysis और Molecular Analysis.
1. Elemental Analysis (तत्वीय विश्लेषण)
इसमें tissues को oxidize (जलाकर) dry weight के आधार पर elements जैसे Carbon (C), Hydrogen (H), Oxygen (O), Nitrogen (N), Phosphorus (P), Sulphur (S) आदि की percentage निकाली जाती है।
2. Molecular Analysis (आणविक विश्लेषण)
इसमें biomolecules जैसे Carbohydrates (कार्बोहाइड्रेट), Proteins (प्रोटीन), Lipids (वसा), Nucleic acids (न्यूक्लिक अम्ल) को chemical extraction और separation techniques द्वारा identify किया जाता है।
Steps of Chemical Analysis (रासायनिक विश्लेषण के चरण)
- Lysis (कोशिका विघटन): सबसे पहले cells या tissues को तोड़ा जाता है।
- Separation (पृथक्करण): Biomolecules को अलग करने के लिए
- Centrifugation (अपकेंद्रण)
- Chromatography (गतिकायनिक विधि)
- Electrophoresis (विद्युतकणगति)
- Detection & Quantification (पहचान और मापन):
- Benedict’s Test → Reducing sugars (शर्करा)
- Biuret Test → Proteins
- Sudan III Test → Lipids
- Spectrophotometry → Nucleic acids
- Elemental Estimation (तत्वों का मापन): Mass spectrometry और X-ray diffraction से सटीक परिणाम मिलते हैं।
| Technique (तकनीक) | Purpose (उद्देश्य) | Example (उदाहरण) |
|---|---|---|
| Centrifugation | Components अलग करना density के आधार पर | न्यूक्लियस, माइटोकॉन्ड्रिया अलग करना |
| Chromatography | Solubility और affinity के आधार पर separation | Amino acids, Pigments |
| Electrophoresis | Charge और size के आधार पर separation | Proteins, DNA/RNA |
| Spectrophotometry | Biomolecules का quantitative analysis | DNA, RNA, Pigments |
Key Point (मुख्य बिंदु)
Living tissues में biomolecules ज्यादा होते हैं, जबकि non-living matter में inorganic compounds. दोनों तरह का analysis life की chemistry समझने के लिए जरूरी है।
Acid Soluble और Acid Insoluble Fractions
जब हम किसी living tissue (जीवित ऊतक) को chemical analysis के लिए treat करते हैं, तो हमें दो मुख्य प्रकार के fractions मिलते हैं:
Acid Soluble Fraction और Acid Insoluble Fraction.
इन fractions में मौजूद biomolecules की nature और function अलग-अलग होती है।
1. Acid Soluble Fraction (अम्ल में घुलनशील अंश)
यह fraction acid (perchloric acid) में घुल जाता है और इसका molecular weight 800 Da से कम होता है।
इसमें simple, small molecules पाए जाते हैं जिन्हें micromolecules कहते हैं।
- Amino acids
- Sugars (Glucose, Fructose)
- Nucleotides
- Vitamins
- Ions (Na⁺, K⁺, Ca²⁺, Mg²⁺)
2. Acid Insoluble Fraction (अम्ल में अघुलनशील अंश)
यह fraction acid में नहीं घुलता और इसका molecular weight 10,000 Da से ज्यादा होता है।
इसमें large, complex molecules पाए जाते हैं जिन्हें macromolecules कहा जाता है।
- Proteins
- Polysaccharides (Starch, Glycogen, Cellulose)
- Nucleic acids (DNA & RNA)
- Lipids (membrane-bound form)
Comparison Table (Acid Soluble vs Acid Insoluble)
| Property (विशेषता) | Acid Soluble Fraction | Acid Insoluble Fraction |
|---|---|---|
| Molecular Weight | < 800 Da | > 10,000 Da |
| Type of Molecules | Micromolecules | Macromolecules |
| Examples | Amino acids, Sugars, Nucleotides, Vitamins | Proteins, Polysaccharides, DNA, RNA, Lipids |
| Role | Metabolism और energy source | Structure और genetic information |
Key Point (मुख्य बिंदु)
Acid soluble fraction में छोटे molecules (building blocks) होते हैं जबकि acid insoluble fraction में बड़े complex molecules (biological macromolecules) होते हैं।
यही molecules मिलकर biochemistry of life को control करते हैं।
Amino Acids (अमीनो अम्ल)
Amino acids जीवित प्राणियों के basic building blocks of proteins होते हैं।
हर amino acid के structure में दो मुख्य groups पाए जाते हैं:
- Amino group (-NH₂)
- Carboxyl group (-COOH)
इन groups के साथ एक Hydrogen atom और एक R group (side chain) जुड़ा होता है।
यही R group हर amino acid को अलग बनाता है।
मानव शरीर में 20 standard amino acids पाए जाते हैं।
Types of Amino Acids (प्रकार)
- Essential amino acids – शरीर इन्हें खुद synthesize नहीं कर सकता, भोजन से प्राप्त करना ज़रूरी है।
- Non-essential amino acids – शरीर इन्हें खुद बना सकता है।
- Conditionally essential amino acids – कुछ विशेष परिस्थितियों में आवश्यक हो जाते हैं।
Table: 20 Standard Amino Acids
| S.No. | Amino Acid (Name) | 3-letter Code | 1-letter Code | Type |
|---|---|---|---|---|
| 1 | Alanine | Ala | A | Non-essential |
| 2 | Arginine | Arg | R | Conditionally Essential |
| 3 | Asparagine | Asn | N | Non-essential |
| 4 | Aspartic acid | Asp | D | Non-essential |
| 5 | Cysteine | Cys | C | Conditionally Essential |
| 6 | Glutamic acid | Glu | E | Non-essential |
| 7 | Glutamine | Gln | Q | Conditionally Essential |
| 8 | Glycine | Gly | G | Non-essential |
| 9 | Histidine | His | H | Essential |
| 10 | Isoleucine | Ile | I | Essential |
| 11 | Leucine | Leu | L | Essential |
| 12 | Lysine | Lys | K | Essential |
| 13 | Methionine | Met | M | Essential |
| 14 | Phenylalanine | Phe | F | Essential |
| 15 | Proline | Pro | P | Non-essential |
| 16 | Serine | Ser | S | Non-essential |
| 17 | Threonine | Thr | T | Essential |
| 18 | Tryptophan | Trp | W | Essential |
| 19 | Tyrosine | Tyr | Y | Conditionally Essential |
| 20 | Valine | Val | V | Essential |
Key Point (मुख्य बिंदु)
Essential amino acids हमें भोजन (diet) से लेने पड़ते हैं, जबकि non-essential amino acids शरीर में खुद बन जाते हैं।
Proteins की structure और function पूरी तरह इन amino acids पर depend करती है।
Essential और Non-Essential Amino Acids
Amino acids को दो groups में बाँटा जाता है – Essential (आवश्यक) और Non-Essential (गैर-आवश्यक)।
Essential Amino Acids वे हैं जिन्हें हमारा शरीर खुद synthesize नहीं कर सकता और इन्हें हमें diet (भोजन) से लेना पड़ता है।
Non-Essential Amino Acids शरीर में खुद बन जाते हैं इसलिए इन्हें खाने से लेना ज़रूरी नहीं।
Essential Amino Acids (आवश्यक)
| S.No. | Amino Acid | Hindi Name |
| 1 | Histidine | हिस्टिडीन |
| 2 | Isoleucine | आइसोल्यूसीन |
| 3 | Leucine | ल्यूसिन |
| 4 | Lysine | लाइसिन |
| 5 | Methionine | मेथियोनीन |
| 6 | Phenylalanine | फेनिलएलनीन |
| 7 | Threonine | थ्रियोनीन |
| 8 | Tryptophan | ट्रिप्टोफैन |
| 9 | Valine | वेलिन |
Non-Essential Amino Acids (गैर-आवश्यक)
| S.No. | Amino Acid | Hindi Name |
| 1 | Alanine | एलनीन |
| 2 | Arginine* | आर्जिनीन* |
| 3 | Asparagine | एस्पारजिन |
| 4 | Aspartic Acid | एस्पार्टिक एसिड |
| 5 | Cysteine | सिस्टीन |
| 6 | Glutamic Acid | ग्लूटामिक एसिड |
| 7 | Glutamine | ग्लूटामिन |
| 8 | Glycine | ग्लाइसिन |
| 9 | Proline | प्रोलाइन |
| 10 | Serine | सेरीन |
| 11 | Tyrosine | टायरोसिन |
Note: Arginine (*) को अक्सर semi-essential माना जाता है क्योंकि यह बच्चों में essential होता है पर adults में शरीर खुद बना लेता है।
Important Amino Acids और उनके Formulas
Amino acids proteins के basic building blocks हैं।
हर amino acid में एक Amino group (-NH2), एक Carboxyl group (-COOH), और एक खास Side chain (R-group) होती है।
यहाँ कुछ महत्वपूर्ण amino acids और उनके molecular formulas दिए गए हैं
| S.No. | Amino Acid | Hindi Name | Chemical Formula |
| 1 | Glycine | ग्लाइसिन | NH2-CH2-COOH |
| 2 | Alanine | एलनीन | CH3-CH(NH2)-COOH |
| 3 | Valine | वेलिन | (CH3)2CH-CH(NH2)-COOH |
| 4 | Leucine | ल्यूसिन | (CH3)2CH-CH2-CH(NH2)-COOH |
| 5 | Isoleucine | आइसोल्यूसीन | CH3-CH2-CH(CH3)-CH(NH2)-COOH |
| 6 | Serine | सेरीन | HO-CH2-CH(NH2)-COOH |
| 7 | Threonine | थ्रियोनीन | CH3-CH(OH)-CH(NH2)-COOH |
| 8 | Phenylalanine | फेनिलएलनीन | C6H5-CH2-CH(NH2)-COOH |
| 9 | Tyrosine | टायरोसिन | HO-C6H4-CH2-CH(NH2)-COOH |
| 10 | Tryptophan | ट्रिप्टोफैन | C8H6N-CH2-CH(NH2)-COOH |
| 11 | Methionine | मेथियोनीन | CH3-S-CH2-CH2-CH(NH2)-COOH |
| 12 | Cysteine | सिस्टीन | HS-CH2-CH(NH2)-COOH |
| 13 | Aspartic Acid | एस्पार्टिक एसिड | HOOC-CH2-CH(NH2)-COOH |
| 14 | Glutamic Acid | ग्लूटामिक एसिड | HOOC-(CH2)2-CH(NH2)-COOH |
| 15 | Lysine | लाइसिन | H2N-(CH2)4-CH(NH2)-COOH |
| 16 | Arginine | आर्जिनीन | H2N-C(=NH)-NH-(CH2)3-CH(NH2)-COOH |
| 17 | Histidine | हिस्टिडीन | C3H3N2-CH2-CH(NH2)-COOH |
| 18 | Proline | प्रोलाइन | NH-(CH2)3-CH-COOH |
Note: यहाँ दी गई formulas structural representation में simplified form में दिए गए हैं। In real chemistry, amino acids exist as zwitterions (–NH3+ और –COO– form में physiological pH पर)।
Protein : Formation और Structure
Proteins जीवन (Life) का आधार माने जाते हैं क्योंकि ये structural, functional और regulatory molecules हैं।
ये Amino acids (20 types) से मिलकर बने होते हैं, जो आपस में Peptide bonds से जुड़े रहते हैं।
1. 2 amino acids आपस में जुड़ते हैं → बनता है Dipeptide।
2. कई amino acids जुड़ते हैं → बनता है Polypeptide chain।
3. कई polypeptide chains आपस में fold होकर → बनाते हैं Protein molecule।
इस process में Dehydration synthesis होती है (water molecule निकलता है)।
Levels of Protein Structure (प्रोटीन की संरचना के स्तर)
| Level | Description (विवरण) | Example (उदाहरण) |
| 1. Primary Structure | Linear sequence of amino acids (सीधी amino acids की श्रृंखला) | Insulin, Pepsin |
| 2. Secondary Structure | Polypeptide chain का folding – α-helix और β-pleated sheets बनते हैं | Keratin (hair), Fibroin (silk) |
| 3. Tertiary Structure | 3D folding due to hydrogen, ionic, disulfide और hydrophobic interactions | Enzymes, Myoglobin |
| 4. Quaternary Structure | 2 या अधिक polypeptide chains का complex arrangement | Hemoglobin (4 subunits), DNA polymerase |
Functions of Proteins (प्रोटीन के कार्य)
- Structural proteins → Hair, Nails, Muscles (Keratin, Collagen)
- Enzymes → Biological catalysts (Amylase, Lipase)
- Transport proteins → Oxygen transport (Hemoglobin)
- Hormonal proteins → Insulin, Glucagon
- Defensive proteins → Antibodies
- Storage proteins → Ferritin (stores iron)
Protein word ग्रीक शब्द “Proteios” से आया है, जिसका अर्थ है “Primary / of first importance”.
Protein Structure: Primary और Secondary
Proteins की संरचना को समझने के लिए इन्हें अलग-अलग स्तरों (Levels) पर classify किया जाता है।
सबसे पहले Primary Structure और उसके बाद Secondary Structure आती है।
1. Primary Structure of Protein
Primary structure simply amino acids की linear sequence को कहते हैं।
यानी protein chain में कौन सा amino acid पहले है, कौन सा बाद में, यह इसकी primary structure define करता है।
इस level पर कोई folding नहीं होती।
– यह केवल peptide bonds से बनी होती है।
– प्रत्येक protein का unique amino acid sequence होता है।
– यदि sequence बदल जाए तो protein का function बदल सकता है।
Example: Insulin का primary structure 51 amino acids से बना होता है।
2. Secondary Structure of Protein
Secondary structure वह level है जहाँ polypeptide chain में folding और coiling होती है।
यह folding hydrogen bonds की वजह से होती है जो nearby amino acids के बीच बनते हैं।
1. α-helix (Alpha helix): Right-handed coil जैसी संरचना, बहुत स्थिर।
2. β-pleated sheet: Chain का zig-zag folding pattern।
Comparison Table
| Feature | Primary Structure | Secondary Structure |
| Definition | Linear sequence of amino acids | Regular folding/coiling of polypeptide chain |
| Bonds Involved | Peptide bonds | Hydrogen bonds |
| Shape | Straight chain, no folding | α-helix or β-pleated sheet |
| Example | Insulin, Pepsin sequence | Keratin (α-helix), Silk fibroin (β-sheet) |
Protein Structure: Tertiary और Quaternary
Proteins की संरचना में Tertiary और Quaternary structure high-level folding और organization को दर्शाती है।
यह folding protein के functional और 3D shape को define करती है।
1. Tertiary Structure of Protein
Tertiary structure वह level है जहाँ entire polypeptide chain 3-dimensional (3D) में fold होती है।
यह folding hydrogen bonds, ionic bonds, disulfide bonds, और hydrophobic interactions की वजह से होती है।
– यह protein की functional shape होती है।
– Single polypeptide chain के लिए यह सबसे high-level folding है।
– Protein का stability और activity largely tertiary structure पर depend करती है।
Examples: Myoglobin, Enzymes like Lysozyme
2. Quaternary Structure of Protein
Quaternary structure तब बनती है जब दो या अधिक polypeptide chains (subunits) आपस में जुड़कर functional protein बनाते हैं।
यह subunits Tertiary structure वाले होते हैं।
– Multiple polypeptide chains assemble into one functional protein।
– Stabilized by same forces as tertiary structure (hydrogen, ionic, disulfide, hydrophobic interactions)।
– Proteins with quaternary structure को multimeric proteins कहते हैं।
Examples: Hemoglobin (4 subunits), DNA polymerase, Immunoglobulins
Comparison Table
| Feature | Tertiary Structure | Quaternary Structure |
| Definition | 3D folding of single polypeptide chain | Assembly of multiple polypeptide chains into functional protein |
| Number of Chains | Single chain | Multiple chains (subunits) |
| Bonds Involved | Hydrogen, Ionic, Disulfide, Hydrophobic | Hydrogen, Ionic, Disulfide, Hydrophobic (between subunits) |
| Examples | Myoglobin, Lysozyme | Hemoglobin, Immunoglobulins |
Protein Structures: Primary, Secondary, Tertiary & Quaternary
| Structure | Description (विवरण) | Bonds Involved (जुड़ने के प्रकार) | Shape | Examples (उदाहरण) |
| Primary | Linear sequence of amino acids in polypeptide chain (Amino acids की सीधी श्रृंखला) | Peptide bonds | Straight chain, no folding | Insulin, Pepsin |
| Secondary | Local folding/coiling of polypeptide chain into regular patterns | Hydrogen bonds | α-helix, β-pleated sheet | Keratin (hair), Silk fibroin |
| Tertiary | 3D folding of entire polypeptide chain, functional shape of single chain | Hydrogen, Ionic, Disulfide, Hydrophobic interactions | 3D globular or fibrous shape | Myoglobin, Lysozyme |
| Quaternary | Assembly of two or more polypeptide chains into functional protein | Hydrogen, Ionic, Disulfide, Hydrophobic interactions between subunits | Complex 3D structure with multiple subunits | Hemoglobin, Immunoglobulins |
Lipids: Structure, Types और Functions
Lipids ऐसे biomolecules हैं जो mainly hydrophobic (पानी में घुलनशील नहीं) होते हैं।
Ye cell में energy storage, structural components और signaling molecules के रूप में काम करते हैं।
Lipids में मुख्य रूप से fats, oils, phospholipids, steroids और waxes शामिल हैं।
1. General Composition
Lipids मुख्य रूप से Carbon (C), Hydrogen (H) और Oxygen (O) से बने होते हैं।
कुछ lipids में Phosphorus (P) और Nitrogen (N) भी पाए जाते हैं।
2. Types of Lipids (प्रमुख प्रकार)
| Type | Description (विवरण) | Example |
| Fats and Oils (Triglycerides) | Glycerol + 3 Fatty acids; energy storage, insulation | Butter, Olive oil |
| Phospholipids | Glycerol + 2 Fatty acids + Phosphate group; cell membrane component | Phosphatidylcholine, Lecithin |
| Steroids | 4 fused carbon rings; hormones and structural function | Cholesterol, Testosterone, Estrogen |
| Waxes | Long chain fatty acids + alcohol; protective coating in plants and animals | Beeswax, Cutin (plant) |
| Sphingolipids | Backbone of sphingosine + fatty acid; cell membrane components, signaling | Ceramide, Sphingomyelin |
3. Functions of Lipids (कार्य)
- Energy storage: Lipids provide long-term energy storage (1g lipid = 9 kcal)
- Structural: Phospholipids and cholesterol form cell membranes
- Insulation: Adipose tissue protects organs and conserves heat
- Signaling: Steroid hormones, eicosanoids act as signaling molecules
- Protection: Waxes protect leaves, fruits, and skin surfaces
4. Saturated and Unsaturated Lipids
Saturated lipids: No double bonds, solid at room temperature (Butter, Ghee)
Unsaturated lipids: One or more double bonds, liquid at room temperature (Olive oil, Mustard oil)
Lipids are essential for life, but excess lipid consumption may lead to cardiovascular diseases.
Plants generally store lipids as oils, whereas animals store lipids as fats.
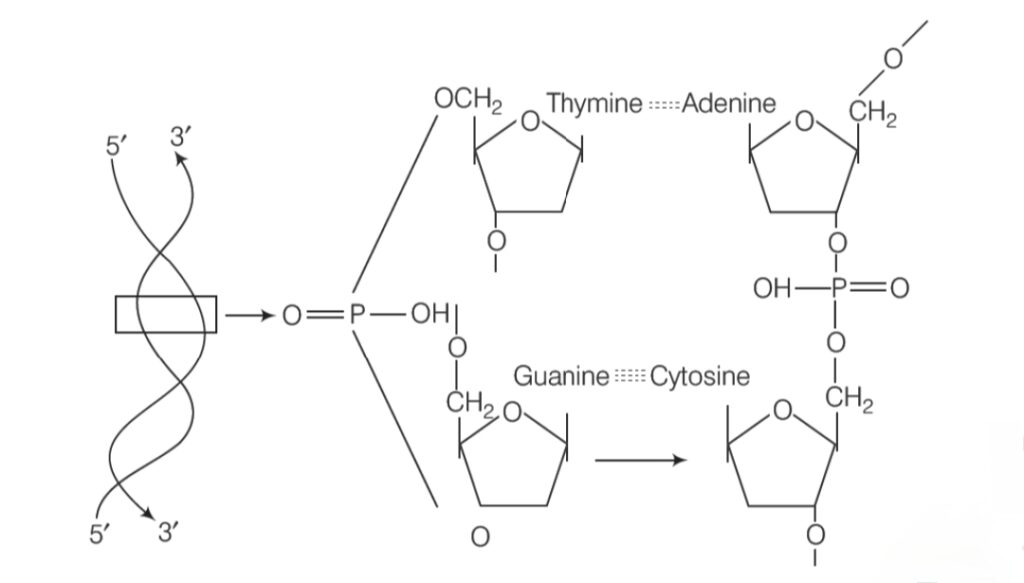
DNA (Deoxyribonucleic Acid) : Structure और Functions
DNA जीवों का genetic material है। यह सभी organisms में heredity और genetic information को store और transmit करता है।
DNA के बारे में सबसे प्रसिद्ध model Watson और Crick (1953) ने प्रस्तुत किया था, जिसे Double Helix Model कहते हैं।
1. Chemical Composition
DNA nucleotides से बना होता है। प्रत्येक nucleotide में तीन components होते हैं:
1. Deoxyribose sugar (5-carbon sugar)
2. Phosphate group
3. Nitrogenous base (4 प्रकार)
• Purines: Adenine (A), Guanine (G)
• Pyrimidines: Cytosine (C), Thymine (T)
2. Structure of DNA
- DNA double-stranded, forming a double helix.
- Strands are antiparallel (एक strand 5’→3′, दूसरा 3’→5′).
- Purines pair with Pyrimidines via hydrogen bonds:
- Adenine (A) — Thymine (T) : 2 hydrogen bonds
- Guanine (G) — Cytosine (C) : 3 hydrogen bonds
- Sugar-phosphate forms the backbone of the DNA strand.
3. Types of DNA
| Type | Description (विवरण) | Example / Location |
| A-DNA | Right-handed helix, compact form | Rarely in dehydrated conditions |
| B-DNA | Standard double helix (Watson-Crick model) | Most common form in living cells |
| Z-DNA | Left-handed helix, zigzag backbone | Found in some genes during transcription |
4. Functions of DNA
- Genetic Material: Store hereditary information
- Replication: DNA replicates before cell division to pass genetic info
- Protein Synthesis: Acts as template for RNA and proteins
- Mutation: Changes in DNA lead to genetic variation
- Evolution: DNA sequence variation drives evolution
DNA को nucleic acid कहा जाता है और यह nucleus के अलावा mitochondria और chloroplast में भी पाया जाता है।
Human DNA लगभग 3 billion base pairs से बना होता है।
RNA (Ribonucleic Acid): Structure और Functions
RNA</b भी एक nucleic acid है, लेकिन यह DNA से अलग है।
RNA मुख्य रूप से protein synthesis और genetic information की temporary transfer में काम आता है।
1. Chemical Composition
RNA nucleotides से बना होता है। प्रत्येक nucleotide में तीन components होते हैं:
1. Ribose sugar (5-carbon sugar)
2. Phosphate group
3. Nitrogenous base (4 प्रकार)
• Purines: Adenine (A), Guanine (G)
• Pyrimidines: Cytosine (C), Uracil (U) – Thymine की जगह Uracil होता है
2. Structure of RNA
- RNA single-stranded होता है।
- RNA में sugar-phosphate backbone होता है।
- Nitrogenous bases A, G, C, U hydrogen bonds से pairing कर सकते हैं (कभी-कभी folding में double-stranded regions बन सकते हैं)।
- RNA की length DNA की तुलना में कम होती है।
3. Types of RNA (RNA के प्रकार)
| Type | Description (विवरण) | Function (कार्य) |
| mRNA (Messenger RNA) | Single-stranded RNA carrying genetic information from DNA to ribosome | Template for protein synthesis |
| tRNA (Transfer RNA) | Small RNA with anticodon at one end and amino acid at the other | Transfers amino acids to ribosome during protein synthesis |
| rRNA (Ribosomal RNA) | Major component of ribosomes | Forms ribosome structure and catalyzes protein synthesis |
| snRNA (Small nuclear RNA) | Found in nucleus, part of spliceosome | RNA splicing |
| miRNA (Micro RNA) | Small regulatory RNA | Regulates gene expression post-transcriptionally |
4. Functions of RNA
- Protein synthesis (translation) में information transfer
- Gene regulation (miRNA, siRNA)
- RNA acts as a catalyst in some reactions (ribozymes)
- Some viruses have RNA as their genetic material
RNA generally has ribose sugar and uracil instead of thymine.
RNA is usually single-stranded but can fold into complex 3D shapes to perform various functions.
Nucleoside और Nucleotide: Full Details
Nucleosides और Nucleotides nucleic acids (DNA और RNA) के building blocks हैं।
इनकी समझ genetics और molecular biology के लिए बहुत महत्वपूर्ण है।
1. Nucleoside (न्यूक्लोसाइड)
Nucleoside = Nitrogenous base + Sugar (रिबोज़ या डिऑक्सीरिबोज़)
Phosphate group नहीं होता.
– Composed of a nitrogenous base (Purine or Pyrimidine) attached to 1’ carbon of sugar.
– No phosphate group present.
– Acts as precursor for nucleotide synthesis.
Examples: Adenosine (A + Ribose), Guanosine (G + Ribose), Thymidine (T + Deoxyribose)
2. Nucleotide (न्यूक्लोटाइड)
Nucleotide = Nucleoside + Phosphate group
यह nucleic acids (DNA और RNA) का actual building block है।
– Phosphate group 5’ carbon of sugar से जुड़ा होता है.
– Nucleotides polymerize करके nucleic acids बनाते हैं।
– Acts as energy carrier (ATP) और signaling molecules (cAMP).
Examples: Adenosine monophosphate (AMP), Guanosine triphosphate (GTP), Cytidine triphosphate (CTP)
3. Comparison Table: Nucleoside vs Nucleotide
| Feature | Nucleoside | Nucleotide |
| Definition | Nitrogenous base + Sugar | Nucleoside + Phosphate group |
| Components | Base + Ribose/Deoxyribose | Base + Sugar + 1 or more Phosphate groups |
| Phosphate Group | Absent | Present |
| Function | Precursor of nucleotide | Building block of nucleic acids, energy transfer (ATP) |
| Examples | Adenosine, Guanosine, Thymidine | AMP, ATP, GTP, CTP |
Nucleotides are essential not only for DNA and RNA but also as energy carriers (ATP) and cellular signaling molecules (cAMP, cGMP).
Primary और Secondary Metabolites
Metabolites वे organic compounds हैं जो plants और microorganisms द्वारा बनाये जाते हैं।
Ye metabolism के products होते हैं। Metabolites को मुख्यतः दो types में divide किया गया है: Primary और Secondary.
1. Primary Metabolites (प्राथमिक उपोत्पाद)
Primary metabolites ऐसे compounds हैं जो organism के normal growth, development और reproduction के लिए आवश्यक हैं।
Ye मुख्य रूप से growth related processes में directly शामिल होते हैं।
| Compound Type | Examples (उदाहरण) | Function / Role (कार्य) |
| Carbohydrates | Glucose, Starch, Cellulose | Energy source, Structural component in cell wall |
| Proteins | Enzymes, Structural proteins | Growth, Enzymatic activity, Structural support |
| Lipids | Fats, Phospholipids | Energy storage, Membrane structure |
| Nucleic acids | DNA, RNA | Genetic material, Protein synthesis |
| Primary metabolites in fermentation | Alcohol, Lactic acid, Citric acid | Produced during growth phase of microorganism |
2. Secondary Metabolites (माध्यमिक उपोत्पाद)
Secondary metabolites ऐसे compounds हैं जो सीधे growth और reproduction में आवश्यक नहीं होते।
Ye mainly organism की defense, competition और ecological interactions में भूमिका निभाते हैं।
Ye growth के बाद late phase में उत्पन्न होते हैं।
| Compound Type | Examples (उदाहरण) | Function / Role (कार्य) |
| Alkaloids | Nicotine, Morphine, Caffeine | Defense against herbivores, stimulant or medicinal use |
| Terpenoids | Menthol, Camphor, Limonene | Protection, Aromatic compounds, Pharmaceutical use |
| Phenolics | Tannins, Lignin, Flavonoids | UV protection, Structural support, Defense |
| Glycosides | Cardiac glycosides (Digoxin), Saponins | Defense, Medicinal use |
| Antibiotics | Penicillin, Streptomycin | Defense against microorganisms |
Primary metabolites are directly involved in normal metabolism, while secondary metabolites are ecological and defensive compounds.
Secondary metabolites are often used in medicine, agriculture, and industry.
Biomacromolecules (जैव-विशाल अणु)
Biomacromolecules वे बड़े molecules हैं जो जीवित कोशिकाओं में पाए जाते हैं।
Ye primarily organic compounds होते हैं और जीवन के लिए आवश्यक कार्यों में भाग लेते हैं।
इनका निर्माण छोटे molecules (monomers) के polymerization से होता है।
1. Types of Biomacromolecules (जैव-विशाल अणुओं के प्रकार)
| Biomacromolecule | Monomer / Building block | Function (कार्य) | Example |
| Carbohydrates (कार्बोहाइड्रेट) | Monosaccharides (Glucose, Fructose) | Energy storage, Structural support (cell wall) | Starch, Glycogen, Cellulose |
| Proteins (प्रोटीन) | Amino acids | Structural, Enzymes, Hormones, Transport | Hemoglobin, Collagen, Insulin |
| Lipids (लिपिड) | Glycerol + Fatty acids | Energy storage, Membrane structure, Signaling | Fats, Phospholipids, Steroids |
| Nucleic acids (न्यूक्लिक एसिड) | Nucleotides | Genetic material, Protein synthesis | DNA, RNA |
| Polysaccharides / Glycoproteins | Monosaccharides / Amino sugar | Structural components, Cell signaling | Mucopolysaccharides, Peptidoglycan |
2. Characteristics of Biomacromolecules
- Large molecules formed by polymerization of monomers.
- Mostly carbon-based (C, H, O) with N, P, S in some molecules.
- Essential for life processes: energy, structure, signaling, heredity.
- May be soluble (sugars, some proteins) or insoluble (cellulose, lipids).
3. Functions (कार्य)
- Energy storage: Carbohydrates (starch, glycogen) and Lipids (fats)
- Structural support: Cellulose in plants, Chitin in arthropods
- Catalysis: Proteins as enzymes
- Genetic information: DNA and RNA
- Signaling and regulation: Hormones (proteins and steroids)
Biomacromolecules are fundamental to life.
Carbohydrates and lipids provide energy, proteins perform structural and enzymatic roles, while nucleic acids store and transmit genetic information.
Average Composition of Cell (कोशिका की औसत संरचना)
| Component (घटक) | Approx. % in cell (कोशिका में लगभग %) | Function / Remarks (कार्य / टिप्पणी) |
| Water (जल) | 70% | Solvent for biochemical reactions, Medium for transport |
| Proteins (प्रोटीन) | 15% | Structural components, Enzymes, Transport molecules |
| Lipids (लिपिड) | 5% | Energy storage, Membrane structure, Signaling |
| Carbohydrates (कार्बोहाइड्रेट) | 3% | Energy source, Structural components (cell wall, glycogen) |
| Inorganic salts (अकार्बनिक लवण) | 1% | Osmotic balance, Enzyme cofactors |
| Nucleic acids (DNA & RNA) | 1% | Genetic material, Protein synthesis |
| Other small molecules (अन्य छोटे अणु) | 5% | Vitamins, cofactors, secondary metabolites |
A living cell is composed mainly of water (70%), followed by proteins (15%). Other biomolecules like lipids, carbohydrates, nucleic acids, and salts make up the rest. This composition ensures proper biochemical and structural functioning.
Polysaccharides (बहुशर्करा)
Polysaccharides carbohydrates का एक प्रकार हैं, जो बहुत सारे monosaccharides के glycosidic linkages से बने होते हैं।
Ye energy storage और structural functions के लिए महत्वपूर्ण हैं।
1. Definition (परिभाषा)
Polysaccharides = Long chain of monosaccharides joined by glycosidic bonds.
Ye simple sugars (monosaccharides) की polymerization से बनते हैं।
2. Types and Examples (प्रकार और उदाहरण)
| Type (प्रकार) | Composition (संरचना) | Function / Role (कार्य) | Examples (उदाहरण) |
| Storage Polysaccharides (ऊर्जा भंडारण) | α-Glucose units | Energy storage in plants and animals | Starch (plants), Glycogen (animals) |
| Structural Polysaccharides (संरचनात्मक) | β-Glucose units | Provides structural support to cell walls and exoskeleton | Cellulose (plants), Chitin (arthropods, fungi) |
| Other Functional Polysaccharides | Various monosaccharide units | Cell recognition, signaling, lubricants | Mucopolysaccharides, Glycosaminoglycans |
3. Characteristics (लक्षण)
- High molecular weight polymers of sugars.
- Can be linear or branched chains.
- Water-soluble (starch) or insoluble (cellulose, chitin).
- Non-reducing in nature (except a few).
4. Functions (कार्य)
- Energy storage: Starch in plants, Glycogen in animals
- Structural support: Cellulose in plant cell walls, Chitin in arthropods
- Cell signaling and recognition: Glycoproteins and mucopolysaccharides
- Protective coating: Exoskeleton, bacterial capsules
Polysaccharides are vital macromolecules that serve as energy reservoirs and structural components.
Plants store energy as starch, while animals store it as glycogen. Cellulose and chitin provide rigidity to plant cell walls and exoskeletons respectively.
Nature of Bond Linking Monomers in Polymers (पॉलीमर में मोनोमर को जोड़ने वाले बंध)
Polymers are large macromolecules made by linking smaller units called monomers.
Monomers are connected through specific chemical bonds depending on the type of polymer.
यह bonding polymer की stability और properties को determine करती है।
1. Types of Bonds in Biopolymers (जैविक पॉलीमर में बंध के प्रकार)
| Polymer Type (पॉलीमर का प्रकार) | Monomers (मोनोमर) | Bond Type (बंध का प्रकार) | Example |
| Carbohydrates (कार्बोहाइड्रेट) | Monosaccharides | Glycosidic bond (α or β) | Starch, Cellulose, Glycogen |
| Proteins (प्रोटीन) | Amino acids | Peptide bond (amide bond) | Enzymes, Structural proteins |
| Nucleic acids (न्यूक्लिक एसिड) | Nucleotides | Phosphodiester bond (between 3′ and 5′ carbon) | DNA, RNA |
| Lipids (लिपिड) | Glycerol + Fatty acids | Ester bond | Fats, Phospholipids |
| Polysaccharide derivatives / Glycoproteins | Sugar + Amino acid | Glycosidic / Peptide linkages | Mucopolysaccharides, Glycoproteins |
2. Key Points (मुख्य बिंदु)
- Bond formation involves condensation reactions (loss of water molecule).
- Breaking the bond involves hydrolysis (addition of water).
- Type of bond affects polymer’s strength, flexibility, and solubility.
- Biological polymers are usually covalently linked.
The nature of bonds connecting monomers defines the properties of polymers.
For example, cellulose has β-1,4-glycosidic bonds which make it rigid, while starch has α-1,4-glycosidic bonds which make it more flexible and digestible.
Dynamic State of Body Constituents & Concept of Metabolism (शरीर के घटकों की गतिशील अवस्था और चयापचय)
Human body और सभी जीवित प्राणियों में constituents जैसे water, proteins, lipids, carbohydrates, nucleic acids, salts लगातार dynamic state में रहते हैं।
यानी ये molecules स्थायी नहीं होते, बल्कि continuous breakdown (catabolism) और re-synthesis (anabolism) के चक्र में रहते हैं।
इस process को Metabolism कहते हैं।
1. Dynamic State of Body Constituents (शरीर के घटकों की गतिशील अवस्था)
- Body constituents हमेशा synthesis और degradation के balance में रहते हैं।
- Proteins और carbohydrates हमेशा degrade होकर energy और new molecules में convert होते हैं।
- Lipids भी metabolic pathways के माध्यम से energy या structural molecules में बदलते हैं।
- Water, electrolytes और ions भी continuously move और exchange होते रहते हैं।
2. Concept of Metabolism (चयापचय की अवधारणा)
Metabolism उन सभी chemical reactions का set है जो body में molecules को synthesize और breakdown करने के लिए होती हैं।
Metabolism को दो मुख्य भागों में divide किया गया है:
| Type | Definition / Description | Example / Function |
| Anabolism (उपचय / निर्माण) | Energy-consuming reactions in which small molecules combine to form larger molecules. | Protein synthesis from amino acids, DNA replication, Glucose → Glycogen |
| Catabolism (अपचय / विघटन) | Energy-releasing reactions in which complex molecules are broken into simpler molecules. | Digestion of carbohydrates, Lipid breakdown, Cellular respiration |
3. Key Points (मुख्य बिंदु)
- Metabolism ensures dynamic equilibrium (homeostasis) in the body.
- Energy released during catabolism is used in anabolism.
- All body constituents are in a constant state of turnover and renewal.
- Metabolism is essential for growth, repair, energy production, and maintaining life.
Dynamic state of body constituents means that body molecules are never static.
Metabolism, through anabolism and catabolism, maintains life by constantly recycling materials and energy.
Metabolic Basis for Living (जीवन के लिए चयापचय का आधार)
Living organisms हमेशा chemical reactions की श्रृंखला में लगे रहते हैं।
Ye reactions energy और molecules के continuous supply के लिए होते हैं।
इस आधार पर कहा जाता है कि metabolism जीवन का मूल आधार है।
सभी biological processes, growth, reproduction, repair, और response, metabolism पर depend करते हैं।
1. Importance of Metabolism (चयापचय का महत्व)
- Provides energy for all cellular processes (ATP synthesis).
- Maintains dynamic state of body constituents (proteins, lipids, carbohydrates).
- Enables biosynthesis of essential molecules (DNA, RNA, proteins).
- Supports growth, repair, and reproduction.
- Helps maintain homeostasis (internal balance of the organism).
2. Metabolism Types (चयापचय के प्रकार)
| Type | Description | Example / Function |
| Anabolism (उपचय) | Energy-consuming reactions to build complex molecules from simpler ones | Protein synthesis, DNA replication, Photosynthesis |
| Catabolism (अपचय) | Energy-releasing reactions to break down complex molecules into simpler ones | Glycolysis, Krebs cycle, Lipid breakdown |
3. Key Points (मुख्य बिंदु)
- Metabolism is central to life; without it, no energy or materials for growth and repair.
- Energy from catabolic reactions drives anabolic reactions.
- Maintains steady-state conditions in cells and tissues.
- All living organisms, from unicellular to multicellular, depend on metabolic pathways.
Metabolism is the chemical engine of life.
It allows organisms to transform matter and energy to sustain growth, reproduction, and survival.
Without metabolism, life cannot exist.
Enzymes (एंज़ाइम्स)
Enzymes biological catalysts होते हैं जो chemical reactions को तेज़ करते हैं बिना खुद consume हुए।
Ye living organisms के लिए metabolic processes में बहुत महत्वपूर्ण हैं।
Enzymes बिना energy की requirement को कम करके reactions को efficiently करते हैं।
1. Definition (परिभाषा)
Enzymes are proteins (mostly) that increase the rate of a chemical reaction by lowering the activation energy.
Ye cellular metabolism के लिए अनिवार्य हैं।
2. Characteristics of Enzymes (एंज़ाइम्स के लक्षण)
- Mostly protein in nature, some RNA molecules act as ribozymes.
- Specific for substrate (Lock and Key / Induced Fit model).
- Not consumed in the reaction; reusable multiple times.
- Highly sensitive to pH, temperature, and inhibitors.
- Lower activation energy of reactions.
3. Classification of Enzymes (एंज़ाइम्स का वर्गीकरण)
| Class (वर्ग) | Function / Reaction Catalyzed (कार्य) | Example (उदाहरण) |
| Oxidoreductases | Oxidation-reduction reactions | Dehydrogenase, Oxidase |
| Transferases | Transfer of functional groups | Transaminase, Kinase |
| Hydrolases | Hydrolysis reactions (breaking bonds with water) | Amylase, Lipase, Protease |
| Lyases | Addition/removal of groups to form double bonds | Decarboxylase, Aldolase |
| Isomerases | Isomerization of molecules | Mutase, Racemase |
| Ligases / Synthetases | Joining of two molecules using ATP | DNA Ligase, Acetyl-CoA synthetase |
4. Factors Affecting Enzyme Activity (एंज़ाइम की गतिविधि पर प्रभाव डालने वाले कारक)
- Temperature: High or low temperature denatures enzyme.
- pH: Each enzyme has optimal pH.
- Substrate concentration: Higher substrate → increased rate up to saturation.
- Enzyme concentration: Higher enzyme → faster reaction.
- Inhibitors: Competitive or non-competitive inhibitors reduce activity.
5. Mechanism of Enzyme Action
Substrate binds to enzyme active site forming enzyme-substrate complex → Reaction occurs → Product is released → Enzyme remains unchanged for next reaction.
Models: Lock and Key and Induced Fit.
Enzymes are essential for life as they accelerate metabolic reactions without being consumed.
They maintain the dynamic state of body constituents by controlling biochemical pathways efficiently.
Enzyme Structure, Coenzyme & Cofactor (एंज़ाइम संरचना, सह-एंज़ाइम और सह-कारक)
Enzymes are biological catalysts, mostly proteins, that accelerate chemical reactions.
Enzyme structure और उनके helper molecules जैसे coenzymes और cofactors उनकी activity और specificity के लिए महत्वपूर्ण हैं।
1. Structure of an Enzyme (एंज़ाइम की संरचना)
- Enzyme proteins में होते हैं, जिनमें primary, secondary, tertiary और quaternary structures शामिल हैं।
- Active site: वह specific site जहाँ substrate bind होता है।
- Substrate binding: Enzyme-substrate complex बनता है और reaction catalyze होती है।
- Enzymes may also require non-protein molecules for activity.
2. Cofactors and Coenzymes (सह-कारक और सह-एंज़ाइम)
| Term (परिभाषा) | Definition / Description | Example |
| Cofactor (सह-कारक) | Non-protein inorganic or organic molecule required for enzyme activity. Helps in catalytic activity. | Metal ions: Mg²⁺, Zn²⁺, Fe²⁺, Cu²⁺ |
| Coenzyme (सह-एंज़ाइम) | Organic cofactor that binds to enzyme and participates in the reaction, often derived from vitamins. | NAD⁺, FAD, Coenzyme A, Biotin |
| Prosthetic group | Tightly bound cofactor or coenzyme permanently attached to enzyme | Heme in Cytochrome, Flavin in Flavoenzymes |
| Apoprotein | Protein part of enzyme without its cofactor | Inactive enzyme without cofactor |
| Holoenzyme | Active enzyme with both protein and cofactor bound | Active form of enzyme (Apoprotein + Cofactor) |
3. Key Points (मुख्य बिंदु)
- Most enzymes are proteins; some are RNA (ribozymes).
- Active site binds substrate and determines specificity.
- Cofactors can be metal ions or organic molecules (coenzymes).
- Holoenzyme = Apoprotein + Cofactor = Active enzyme.
- Prosthetic groups are permanently attached to enzyme.
Enzyme structure is crucial for its function. Cofactors and coenzymes are helper molecules that assist enzymes in catalysis.
Without these, many enzymes remain inactive and cannot perform biological reactions efficiently.
Different Enzymes Found in Living Organisms with Functions (जीवों में पाए जाने वाले एंज़ाइम और उनके कार्य)
| Enzyme (एंज़ाइम) | Substrate / Reaction (उपकरण / प्रतिक्रिया) | Function / Role (कार्य) | Example Organism (उदाहरण) |
| Amylase | Starch → Maltose | Carbohydrate digestion | Humans, Plants, Bacteria |
| Lipase | Triglycerides → Glycerol + Fatty acids | Fat digestion | Humans, Animals, Fungi |
| Protease / Peptidase | Proteins → Amino acids | Protein digestion | Humans, Animals, Microbes |
| DNA Polymerase | DNA replication | Synthesizes new DNA strands | All living cells |
| RNA Polymerase | DNA → RNA | Transcription | All living cells |
| ATP Synthase | ADP + Pi → ATP | ATP production in mitochondria / chloroplast | Plants, Animals |
| Amylase (Salivary) | Starch → Maltose | Initial digestion of starch in mouth | Humans |
| Pepsin | Proteins → Peptides | Protein digestion in stomach | Humans, Mammals |
| Lactase | Lactose → Glucose + Galactose | Digestion of milk sugar | Humans, Mammals |
| Catalase | H₂O₂ → H₂O + O₂ | Detoxification of hydrogen peroxide | Humans, Animals, Plants, Bacteria |
| Amylase (Pancreatic) | Starch → Maltose | Digestion of starch in small intestine | Humans, Mammals |
| Sucrase | Sucrose → Glucose + Fructose | Sugar digestion | Humans, Animals |
| Hexokinase | Glucose → Glucose-6-phosphate | Initial step of glycolysis | Humans, Animals, Plants |
| RNAse | RNA → Nucleotides | Breakdown of RNA | Humans, Animals, Plants |
| DNAse | DNA → Nucleotides | Breakdown of DNA | Humans, Animals, Plants |
Working of an Enzyme & Factors Affecting Enzyme Activity (एंज़ाइम का कार्य और प्रभावित करने वाले कारक)
1. Working of an Enzyme (एंज़ाइम का कार्य)
Enzymes biological catalysts होते हैं जो reactions को तेज़ करते हैं।
Enzyme काम कैसे करता है इसे समझने के लिए मुख्य steps नीचे दिए गए हैं:
- Substrate Binding: Substrate enzyme के active site में bind करता है, forming an enzyme-substrate complex.
- Catalysis: Enzyme active site में substrate के bonds को destabilize करता है, जिससे reaction आसान हो जाती है और activation energy कम हो जाता है.
- Product Formation: Substrate reactions के माध्यम से product में बदलता है.
- Product Release: Product enzyme से release होता है और enzyme free हो जाता है, अगले reaction के लिए ready.
Mechanism Models:
1. Lock and Key Model: Substrate exact active site से fit होता है.
2. Induced Fit Model: Active site substrate bind होने पर slight shape change करता है ताकि perfect fit हो जाए.
2. Factors Affecting Enzyme Activity (एंज़ाइम गतिविधि को प्रभावित करने वाले कारक)
| Factor (कारक) | Effect on Enzyme Activity (एंज़ाइम गतिविधि पर प्रभाव) | Example / Note |
| Temperature (तापमान) | Optimal temperature पर activity maximum होती है; High temperature → denaturation, Low temperature → slow reaction | Human enzymes optimum ~37°C |
| pH | Each enzyme has an optimal pH; deviation reduces activity due to ionization changes at active site | Pepsin: pH 2, Trypsin: pH 8 |
| Substrate Concentration (उपकरण सांद्रता) | Increase in substrate → reaction rate increases up to saturation | Michaelis-Menten kinetics |
| Enzyme Concentration (एंज़ाइम सांद्रता) | Higher enzyme → faster reaction (if substrate is in excess) | In vitro enzyme assays |
| Inhibitors (अवरोधक) | Reduce enzyme activity; Competitive inhibitors bind active site, Non-competitive inhibitors bind elsewhere | Penicillin inhibits bacterial transpeptidase |
| Cofactors / Coenzymes | Required for enzyme activity; absence → enzyme inactive | Mg²⁺, Zn²⁺, NAD⁺, FAD |
Enzymes speed up reactions by lowering activation energy.
Activity depends on temperature, pH, substrate and enzyme concentration, inhibitors, and cofactors.
Optimal conditions maximize efficiency of metabolic reactions.
Lock and Key Model of Enzyme (एंज़ाइम का लॉक और की मॉडल)
Lock and Key Model सबसे पहले Emil Fischer (1894) ने प्रस्तुत किया था।
इस मॉडल के अनुसार, enzyme का active site बिल्कुल substrate के shape के अनुरूप होता है, जैसे lock में key फिट होती है।
1. Steps of Lock and Key Model (चरण)
- Substrate binding: Substrate active site में perfectly fit होता है।
- Formation of enzyme-substrate complex: Substrate enzyme के active site से जुड़ जाता है।
- Catalysis: Substrate chemical reaction से product में बदलता है।
- Product release: Product enzyme से अलग हो जाता है और enzyme free हो जाता है।
2. Features (विशेषताएँ)
- Active site और substrate की shape complementary होती है।
- Specificity high होती है; enzyme केवल particular substrate पर कार्य करता है।
- Enzyme-substrate complex temporarily बनता है।
- Reaction के बाद enzyme reusable रहता है।
3. Limitations (सीमाएँ)
- Active site को rigid मानता है; substrate के slight structural change पर model fail हो सकता है।
- Induced Fit Model के अनुसार enzyme active site flexible होता है, इसलिए Lock & Key पूरी तरह से सभी enzymes पर लागू नहीं होता।
Lock and Key Model explains enzyme specificity.
It is an early model and forms the basis for understanding enzyme-substrate interaction, though modern studies prefer the Induced Fit Model for flexibility of active site.
External Links for Biomolecules Chapter
- NCERT Class 11 Biology – Biomolecules (Official PDF)
- Khan Academy – Macromolecules & Biomolecules
- Toppr – Biomolecules Notes and Examples
- Embibe – Class 11 Biomolecules
- Vedantu – Biomolecules Detailed Notes
Read more chapters:-
- Living worldLiving world chapter 1
- Biological classificationBiological classification
- Anatomy of flowering plantsAnatomy of flowering plants